Vol. 2° - I.1.3.
Legami
intermolecolari
Forze di Van der Waals
Legame a idrogeno
Due molecole qualsiasi che si trovino a una distanza <1nm, esercitano l’una sull’altra un’attrazione di tipo elettrostatico di Van der Waals.
Tale interazione risulta notevole tra molecole caratterizzate da momento dipolare non nullo. Si parla in questo caso di legame dipolo-dipolo: la carica elettrica di una molecola genera un campo elettrico, nel quale una qualsiasi altra molecola polare si orienta in modo che la parte positiva di essa viene attratta dalla parte negativa della prima molecola e viceversa. Le forze di Van der Waals possono originarsi anche tra molecole prive di dipoli elettrici.
È prevedibile che le forze di Van der Waals siano più intense tra molecole di maggiori dimensioni, sia perché la presenza di molti elettroni rende possibile la formazione simultanea di più dipoli elettrici, sia perché una nuvola elettronica esterna è legata al nucleo più debolmente ed è quindi più facilmente deformabile.
Tale considerazione trova riscontro nella stretta relazione esistente tra il peso molecolare di una sostanza e i suoi punti di fusione e di ebollizione. Questi parametri, che rappresentano la misura dell’agitazione molecolare necessaria per superare le forze intermolecolari (rispettivamente dello stato solido e dello stato liquido), risultano infatti tanto più elevati quanto più grandi sono le dimensioni della molecola.
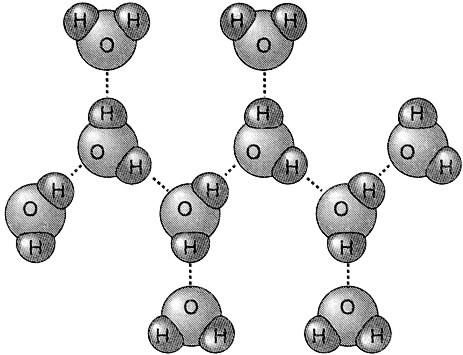
Fig. I. 2 - Legame a
idrogeno
Molecole di acqua unite tra
loro da legami a idrogeno.
Il legame tra ossigeno e idrogeno è in gran parte di natura covalente polare. Dai valori di elettronegatività è infatti calcolabile un carattere ionico di tale legame pari a circa il 30-40%. Ciò comporta una separazione di cariche - positive sugli atomi di idrogeno e negative sull’atomo di ossigeno - che rende possibile la formazione di un legame elettrostatico tra l’atomo di idrogeno di una molecola e quello di ossigeno di un’altra molecola.
Il legame che così si manifesta prende il nome di legame a idrogeno e fa risentire il suo effetto sulle proprietà chimicofisiche di molte sostanze. Quando si instaura un legame a idrogeno, l’atomo d’idrogeno viene ad essere unito a due atomi di due molecole diverse, così da formare tra esse una specie di ponte, il ponte a idrogeno.
I legami a idrogeno presi singolarmente hanno un effetto trascurabile sulle proprietà fisiche di una sostanza. Va tuttavia tenuto presente che, per effetto della formazione di questi legami intermolecolari, tutte le molecole vengono ad essere unite fra loro e si ha per conseguenza un fenomeno di cooperatività, cioè l’energia necessaria per separare le molecole è superiore alla somma delle energie dei singoli legami a idrogeno.