Lessico
Pipita
o pituita
Difterovaiolo aviare
Pipita deriva dal latino parlato pipita al posto del classico pituita che significava muco, catarro, raffreddore, lacrimazione, pus, ascesso, gomma delle piante, pipita dei polli. Pipita è da ricondurre alla radice indeuropea *pi- di pinus (pino) e pix (pece) che indicava grasso, umore, succo, in quanto la secrezione può assumere la consistenza della resina o della pece.
In italiano la pipita è anche quella pellicola cutanea che si solleva ai lati delle unghie, data la sua somiglianza con quella pellicola che si forma sulla lingua dei polli e che, come questa, viene spesso asportata.
Nessuna
delle fonti più autorevoli a mia disposizione ha il coraggio di dire che nel
caso del pollo la pipita o pituita corrisponde anche a una delle tre forme
cliniche che possono essere assunte dal difterovaiolo aviare![]() ,
e precisamente alla forma difterica,
difterica in quanto, come vuole l'etimologia greca di difterite, in questa
forma si generano delle membrane a livello delle prime vie aeree, e il greco diphthéra significa appunto pelle conciata, cuoio,
membrana.
,
e precisamente alla forma difterica,
difterica in quanto, come vuole l'etimologia greca di difterite, in questa
forma si generano delle membrane a livello delle prime vie aeree, e il greco diphthéra significa appunto pelle conciata, cuoio,
membrana.
Le altre due forme cliniche del difterovaiolo aviare sono la vaiolosa e l'infiammatoria catarrale, simile quest’ultima alla corizza infettiva - o contagiosa che dir si voglia - causata invece dall'Haemophilus gallinarum.
Esiste anche la laringotracheite infettiva, che colpisce solo polli e fagiani, causata dal Phasianid herpes-virus appartenente alla famiglia Herpesviridae. Il difterovaiolo è invece causato da un virus appartenente al gruppo dei pox virus, cioè quei virus che causano delle pustole, essendo l'inglese pox un derivato da pocks, plurale di pock, pustola.
Che le fonti siano carenti d’informazione lo dimostra il fatto che un giorno dovetti fornire l’equivalente scientifico della parola dialettale valenzana puija all’amico Alberto Lenti che stava ultimando un articolo di arte culinaria relativa al pollo. Nel dialetto di Valenza la puija è la pipita, sia delle unghie umane che della lingua del pollo.
Ipofisi
ex ghiandola pituitaria
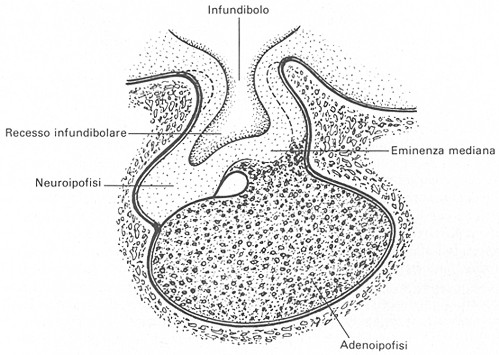
L’ipofisi
- che prende il nome dal greco hypóphysis = gonfiore, escrescenza - è
una piccola ghiandola endocrina accolta nella sella turcica, scavata sulla
superficie dorsale dell’osso sfenoide del cranio. Questa ghiandola è in
stretto rapporto, superiormente, con la regione ipotalamica del diencefalo al
quale è collegata dal peduncolo ipofisario. Essa fu descritta da Galeno![]() .
Per maggiori dettagli anatomici e funzionali si veda il relativo capitolo in Summa
Gallicana
.
Per maggiori dettagli anatomici e funzionali si veda il relativo capitolo in Summa
Gallicana![]() a proposito dell'istinto di cova.
a proposito dell'istinto di cova.
Andrea Vesalio e la ghiandola pituitaria
Andrea
Vesalio![]() - alias André van Wesele (1514-1564) - usando il termine latino pituita
nel significato di muco, denominò l’ipofisi ghiandola pituitaria
nella convinzione che secernesse il muco nasale. Si dovette attendere fino al
1849 per una corretta interpretazione dell’azione di un ormone, e quindi
delle ghiandole endocrine come l’ipofisi.
- alias André van Wesele (1514-1564) - usando il termine latino pituita
nel significato di muco, denominò l’ipofisi ghiandola pituitaria
nella convinzione che secernesse il muco nasale. Si dovette attendere fino al
1849 per una corretta interpretazione dell’azione di un ormone, e quindi
delle ghiandole endocrine come l’ipofisi.
Fu quando Arnold-Adolph Berthold di Gottinga (1803-1861) castrò dei galletti: quelli lasciati senza testicoli divennero capponi, mentre quelli ai quali lasciò cadere un loro testicolo fra le anse intestinali divennero fenotipicamente dei galli. Il successivo esame anatomico mostrò che il testicolo si era attaccato all'intestino e aveva ottenuto una buona irrorazione sanguigna.
Ma tale esperimento non venne riconosciuto nella sua importanza, tant'è che la prima descrizione anatomoclinica dell'acromegalia ad opera di Andrea Verga nel 1864 venne inserita lungo la linea di sviluppo della craniologia e non dell'endocrinologia.
da Patologia aviare di Gampaolo Asdrubali
Pitagora Editrice - Bologna - 1986
Introduzione
Il difterovaiolo aviare è una malattia infettiva e contagiosa caratterizzata dalla formazione di pseudomembrane difteriche sulla mucosa delle prime vie respiratone e digerenti e da noduli vaiolosi sulla cute. Sebbene il difterovaiolo si osservi prevalentemente nel polo domestico, esso può colpire anche tacchini, piccioni, varie specie di uccelli selvatici e i canarini.
A lungo si è ritenuto che la cosiddetta difterite e il vaiolo o epitelioma contagioso fossero due malattie distinte sostenute da agenti eziologici differenti; ricerche sperimentali hanno dimostrato l’unicità eziologica di tali infezioni. È possibile infatti ottenere in polli sani lesioni difteriche con l’inoculazione sulle mucose di materiale prelevato da noduli vaiolosi e produrre quelle vaiolose mediante innesto sulla cute per scarificazione di materiale difterico prelevato dalla mucosa orale.
Eziologia
Il virus
responsabile di questa malattia appartiene al gruppo dei pox virus![]() (a DNA).
Esso ha forma di mattone oppure ovoidale e dimensioni notevoli (265 x 334 nm).
(a DNA).
Esso ha forma di mattone oppure ovoidale e dimensioni notevoli (265 x 334 nm).
Si ammette oggi la pluralità del virus e se ne differenziano 4 tipi: virus pollo, virus piccione, virus tacchino e virus canarino. Ciascuno di questi è capace di infettare più di una specie di uccelli. Il virus pollo, ad esempio, è patogeno anche per ii tacchino; il virus tacchino è patogeno anche per il pollo e il piccione. Tutti i 4 tipi di virus crescono e si sviluppano sulla membrana corionallantoidea dell’embrione di pollo e su fibroblasti di embrione di pollo. Vi è immunità crociata tra virus piccione e virus pollo e tra virus pollo e virus tacchino. Tutti i ceppi virali del difterovaiolo sono molto resistenti agli agenti naturali (sole, essiccamento, freddo) e sopportano una temperatura di 60 °C per 8 minuti; essi inoltre vengono uccisi in 5 minuti dalla soda caustica all’1-2%, mentre resistono alla formalina al 3% e al cresolo al 3% per 10 minuti.
Epizoologia e patogenesi
La disseminazione del virus avviene con gli sbruffi, con gli essudati oculari e le croste distaccatesi dagli animali infetti. Il contagio indiretto può avvenire a mezzo di alimenti, acqua di bevanda, materiali vari contaminati. Mosche, moscerini, uccelli selvatici e soprattutto zanzare possono essere veicoli non infrequenti di diffusione. La malattia si può osservare nel corso di tutto l’anno, ma con maggiore incidenza in estate e in autunno.
Il virus penetra nell’organismo attraverso soluzioni di continuo della cute e delle mucose. Dal punto di entrata raggiunge il circolo sanguigno per localizzarsi successivamente ai tessuti di elezione.
È stato osservato che la vaccinazione nei confronti della laringotracheite infettiva può favorire l’insorgere di episodi di difterovaiolo, in quanto il virus vaccinale, replicando nella mucosa laringotracheale, determina in questa sede alterazioni infiammatorie con desquamazione epiteliale, che rendono possibile la penetrazione del virus vaioloso attraverso queste soluzioni di continuo.
Sebbene la malattia possa avere un decorso acuto nel singolo animale, essa in genere si diffonde piuttosto lentamente all’interno dell’allevamento. Il periodo di incubazione varia tra 5 e 10 giorni.
Sintomi e lesioni
La malattia può presentarsi in tre forme differenti
Forma vaiolosa. È contraddistinta dalla comparsa di noduli che hanno l'apparenza dapprima di papule, indi di bottoni verrucosi grigio-giallastri, sulla cresta, sulle palpebre, sui bargigli e talvolta anche sulle parti del corpo coperte di penne. Meno frequente è la localizzazione alle dita e alle zampe che si osserva soprattutto nei broilers. Successivamente tali noduli si disseccano e finiscono poi col cadere. La forma vaiolosa è da considerarsi come la meno grave. Infatti nei casi non complicati il processo morboso ha un’evoluzione benigna e a esso segue generalmente la guarigione.
Forma vaiolosa
mercoledì
13 agosto 2008
con la collaborazione di Franco Omodeo
Forma difterica. È caratterizzata dalla comparsa di pseudomembrane cruposo-difteriche di varia grandezza, grigio-giallastre, sulle mucose delle prime vie aeree e digerenti e in particolare su quella oro-faringea, della laringe e della trachea. Esse aderiscono fortemente ai tessuti sottostanti, per cui, se staccate, mostrano al di sotto superfici emorragiche, spesso sanguinolente. A queste lesioni corrispondono sintomi funzionali di notevole gravità e con frequenza si osserva impossibilità, per gli animali ammalati, a deglutire gli alimenti, respirazione difficile e rantolosa, rapido dimagramento. Tale forma può decorrere in un periodo di tempo variabile da 8-10 giorni a 1-2 mesi e condurre a morte un numero abbastanza elevato di soggetti. Essa può essere aggravata da germi d’irruzione secondaria.
Forma infiammatoria catarrale o di tipo III. Si manifesta con una sintomatologia molto simile a quella della corizza infettiva. I volatili presentano infatti un'intensa infiammazione catarrale della mucosa nasale e congiuntivale con complicanze a carattere purulento a carico del seno infraorbitale e dell’occhio. Secondo alcuni Autori questa forma non sarebbe dovuta a! virus del difterovaiolo, ma sarebbe soltanto una corizza complicante il quadro del difterovaiolo. Sempre secondo tali Autori infatti, queste due malattie possono essere talvolta associate, dando l’impressione erronea dell'esistenza di una “forma catarrale” del difterovaiolo.
L’evoluzione dell’affezione diftero-vaiolosa non sempre avviene con i sintomi e le lesioni esclusive e ben distinte di ogni singola forma, poiché talvolta si osserva la comparsa di forme miste con concomitanza di lesioni difteriche, vaiolose e catarrali.
Nelle galline ovaio!e il difterovaiolo porta a una riduzione della capacità produttiva e dalle uova deposte durante l’infezione la percentuale di pulcini nati morti o deformi può raggiungere cifre ragguardevoli.
I reperti istologici sono caratteristici e pertanto utili ai fini diagnostici. A livello della cute e delle mucose interessate si osserva iperplasia epiteliale, alterazioni infiammatorie e soprattutto presenza di voluminosi corpi inclusi eosinofili nel citoplasma delle cellule epiteliali infette; questi si rinvengono a diverso stadio di sviluppo; spesso i corpi inclusi occupano gran parte del citoplasma che appare otticamente vuoto, mentre il nucleo va incontro a distruzione.
I corpi inclusi delle cellule epiteliali infette della cute furono scoperti dall’italiano Rivolta (1869). Bollinger (1873), attraverso studi istologici li differenziò dai corpi inclusi del vaiolo dei mammiferi. Dai nomi di questi Autori i corpi inclusi furono chiamati corpi di Rivolta-Bollinger. Borrel (1904), invece, ha dato ii suo nome ai corpuscoli elementari contenuti nei corpi inclusi e che egli evidenziò in strisci ottenuti da lesioni cutanee.
Diagnosi
I sintomi e le lesioni che presentano i volatili colpiti da affezioni difterovaiolose sono abbastanza tipici, sì da permettere, nella maggioranza dei casi, una sicura diagnosi della malattia. Nei casi dubbi si ricorrerà ai seguenti esami:
esame istologico: con questo esame si mettono in evidenza gli inclusi di Rivolta-Bollinger nelle cellule epiteliali della cute o delle mucose lese;
prova biologica: consiste nell’inoculazione a un volatile sano, per scarificazione cutanea, di materiale sospetto prelevato da un soggetto ammalato; se si tratta di difterovaiolo si osserva la comparsa delle tipiche lesioni cutanee nel giro di 5-7 giorni;
isolamento del virus: il virus del difterovaiolo può essere isolato inoculando su uova embrionate di 9-10 giorni una sospensione del materiale sospetto; l’inoculo avviene sulla membrana corionallantoidea, nella quale, nello spazio di 3-4 giorni, si formano delle placche ben visibili e piuttosto caratteristiche.
Diagnosi differenziale
Le malattie che possono essere confuse con il difterovaiolo sono la corizza contagiosa, la ipovitaminosi A, le stomatiti micotiche e, nel piccione, la tricomoniasi.
Profilassi
La
profilassi diretta si basa sul controllo delle condizioni ambientali e dello
stato sanitario dei soggetti in allevamento, nonché sulle disinfezioni e
disinfestazioni periodiche. Da sola, tuttavia, non è in grado di evitare la
comparsa della malattia.
Precipua importanza assume quindi la profilassi indiretta o vaccinale.
Oggigiorno sono largamente usati nella pratica vaccini a virus vivo attenuato.
Due tipi di virus vengono al momento adoperati per l’allestimento di vaccini
da usare nella prevenzione del difterovaiolo: il virus pollo e il virus
piccione.
I sistemi di vaccinazione più in uso sono la scarificazione (brush method) con un pennello duro che, bagnato nel vaccino, viene passato energicamente su una zona degli arti dove sono state strappate in precedenza alcune penne e la puntura all’ala (stick method) mediante un apposito ago che ha una scanalatura e che si intinge nel materiale vaccinale. Questo secondo metodo è più pratico e di maggiore convenienza economica per l’allevatore.
I tipi di vaccini che si preparano attualmente sono i seguenti.
Vaccino vivo avianizzato attenuato ceppo piccione. È allestito con il virus del difterovaiolo del piccione, coltivato su embrione di pollo. Il ceppo piccione nei riguardi del ceppo pollo presenta i seguenti vantaggi: a) può essere somministrato anche a polli molto giovani; b) dà uno stress minore. Lo svantaggio maggiore è di dare immunità di durata inferiore.
Vaccino vivo avianizzato attenuato ceppo pollo. È allestito con ii virus del difterovaiolo del pollo, coltivato su uova embrionate. Tale vaccino è dotato di un alto potere immunizzante, sempre che opportuna sia stata la scelta del ceppo vaccinale. Esso viene impiegato nei polli in cui dà un'immunità che dura per tutta la vita economica dei volatili.
Vaccino vivo attenuato ceppo pollo preparato su colture di tessuto. Con questo tipo di vaccino si evitano le preoccupazioni relative alle malattie di cui i vaccini su uova embrionate possono essere ii veicolo e inoltre, poiché si può aggiungere un adiuvante, esso dà luogo a una risposta immunitaria potenziata.
La vaccinazione deve essere eseguita in animali in buone condizioni di salute, esenti da malattie, ben nutriti, su cui non abbiano agito di recente agenti stressanti di qualunque natura essi siano. La risposta immunitaria si ottiene dopo circa due settimane ed è completa dopo la terza settimana.
Nei broilers l’intervento vaccinale si può eseguire anche a partire dai primi giorni di età. Siccome la vita economica di tali soggetti è breve, non è richiesta un'immunità di lunga durata: si può pertanto ricorrere al virus eterologo di piccione per puntura alare.
Nelle ovaiole invece l’immunità deve essere di lunga durata, tale da coprire l’intera vita economica degli animali. In genere si ricorre a due interventi vaccinali, il primo a 3-4 settimane di età con ceppo piccione per puntura alare, il secondo a 16-18 settimane di età con ceppo pollo, sempre per puntura alare.
Nei tacchini si può ricorrere sia al vaccino preparato con ceppo pollo che con ceppo piccione; si preferisce vaccinare per puntura alare intorno alle 6-8 settimane.
Nei piccioni, infine, si ricorre a vaccini a base di virus piccione a patogenicità controllata, da utilizzare per scarificazione a 4-6 settimane di età.
Misure di polizia veterinaria.
Il difterovaiolo è malattia soggetta a denuncia ai sensi del regolamento di polizia veterinaria (D.P.R. 8 febbraio 1954, n. 320).
Avipoxvirus is a member of the Poxviridae family. The Poxviridae family is the family of viruses which cause the victim organism to have poxes as a symptom. This pox virus is one that affects birds only. Poxviruses have generally large genomes, and other such examples include smallpox and monkeypox. Although it is comparably slow-spreading, Avipoxvirus is known to cause symptoms like pustules full of pus lining the skin and diphtheria-like symptoms. These diphtheria-like symptoms might include diphtheric necrotic membranes lining the mouth and the upper respiratory tract. This disease can be transmitted to humans by unusually close contact with birds that are infected or the consuming of liquids or solids that have been in extremely close contact with an infected bird. Not unlike other avian viruses, it can be transmitted through vectors mechanically such as through mosquitoes.
Avipoxvirus is a virus that is brick shaped and is usually 200 nanometers in diameter. This is much larger than normal viruses which are around 60 nanometers in diameter. This virus can only be contracted through vectors and consumption of infected items, but they can be filtered by a special water filter. This filter is called a Large Volume Water Sampler (LVWS).
Unlike other viruses, Avipoxvirus can withstand extreme dryness. With this advantage, it can spread on dust particles. This is because it has adapted to living in the dry mucous membranes of an infected host's upper respiratory tract.
As this virus is a poxvirus, it has a high mortality rate in birds, like it does in humans. The effects of this virus might increase the difficulty of breathing, eating, and drinking significantly. Exterior lesions are restricted to the non-feathered parts of the body, usually the face and legs and are characterized by proliferative and necrotizing dermatitis. Another feature of this bird pox that has been observed is the presence of blood sacs or blisters filled with bloody fluid that will collapse when pierced with a needled and allowed to drain. This virus has the highest mortality rate in upland gamebirds such as songbirds, marine birds such as seagulls, parrots, and some raptors such as the peregrine falcon. If the victim of the virus survives long enough to breed, then the offspring will become mentally retarded.
Other names for this peculiar virus might include avian pox, fowlpox, canarypox, juncopox, mynahpox, and many other names that correspond with its peculiar characteristics.
Fowlpox is a worldwide disease of poultry caused by viruses of the family Poxviridae and the genus Avipoxvirus. The viruses causing fowlpox are distinct from one another but antigenically similar, possible hosts including chickens, turkeys, quail, canaries, pigeons, and many other species of birds. There are two forms of the disease. The first is spread by biting insects (especially mosquitoes) and wound contamination and causes lesions on the comb, wattles, and beak. Birds affected by this form usually recover within a few weeks. The second form is spread by inhalation of the virus and causes a diphtheritic membrane to form in the mouth, pharynx, larynx, and sometimes the trachea. The prognosis for this form is poor.
Vaccines are available for fowlpox. Chicken are usually vaccinated with pigeonpox virus. Turkeys are also routinely vaccinated.
Avipoxvirus
Cite this publication as: ICTVdB Management (2006). 00.058.1.03. Avipoxvirus. In: ICTVdB - The Universal Virus Database, version 4. Büchen-Osmond, C. (Ed), Columbia University, New York, USA
Cite this site as: ICTVdB - The Universal Virus Database, version 4.
www.ncbi.nlm.nih.gov/ICTVdb/ICTVdB/index.htm
Classification
This is
a description of a vertebrate virus at the genus level.
ICTVdB Virus Code: 00.058.1.03. Virus accession number: 058103GE. Obsolete
virus code: 58.1.3.; superceded accession number: 58130000.
NCBI Taxon Identifier NCBI Taxonomy ID: 10260.
Name, Synonyms and Lineage
Synonym(s): Fowlpox subgroup. Virus is of the subfamily 00.058.1. Chordopoxvirinae; of the family 00.058. Poxviridae.
Virion Properties
Morphology
Virions consist of an envelope, a surface membrane, a core, and lateral bodies, or a surface membrane, a core, and lateral bodies. During their life cycle, virions produce extracellular particles and produce intracellular particles; can occur in two phenotypes; may be enveloped during their extracellular phase. The infection is initiated by extracellular virions. Virus may be sequestered within inclusion bodies that are not occluded and typically contain one nucleocapsid. Virus capsid is enveloped and mature naturally by budding through the membrane of the host cell; brick-shaped to pleomorphic. Virions measure 200 nm in diameter, or 260-280 nm in diameter; 330-350 nm in length displaying tubular units. The core is biconcave with two lateral bodies. Lateral bodies are lens-shaped. Nested between the core membrane, or between the surface membrane. Contains a folded nucleoprotein thread.
Physicochemical and Physical Properties
Virions have a buoyant density in CsCl of 1.23-1.27 g cm-3.
Nucleic Acid
The genome is not segmented and contains a single molecule of linear double-stranded DNA. The complete genome is 130000-150000 nucleotides long. The genome has a guanine + cytosine content of 35 %. The genome sequence has termini with cross-linked hairpin ends (i.e. single-stranded loopes thus forming one continuous polynucleotide chain). The genome has terminally redundant sequences. The terminally redundant sequences have reiterated inverted terminal sequences which are tandemly repeated; are reiterated internally. The genome sequence is repeated at both ends. Double-stranded DNA is covalently. Double-stranded DNA is linked at both ends.
Proteins
The viral genome encodes structural proteins and non-structural proteins.
Lipids
Lipids are present and located in the envelope. Virions are composed of 4% lipids by weight. The composition of viral lipids and host cell membranes are similar. The lipids are host derived and synthesized de novo (during the early phase of virus replication) and are derived from plasma membranes. Viral membranes include glycolipids.
The description has been compiled from data in the ICTV Report presented by Esposito JJ, Baxby D, Black DN, Dales S, Darai G, Dumbell KR, Granados RR, Joklik WK, McFadden G, Moss B, Moyer RW, Pickup DJ, Robinson AJ, Tripathy DN.
www.ictvonline.org
Fowlpox
in Chickens and Turkeys
Fowlpox is a slow-spreading viral infection of chickens and turkeys characterized by proliferative lesions in the skin (cutaneous form) that progress to thick scabs and by lesions in the upper GI and respiratory tracts (diphtheritic form). It is seen worldwide.
Etiology and Epidemiology
The large DNA virus (an avipoxvirus, family Poxviridae) is highly resistant and may survive for several years in dried scabs. Field and vaccine strains have only minor differences in their genomic profiles, although the strains can be differentiated to some extent by restriction endonuclease analysis, and immunoblotting. Recently, molecular analyses of vaccine and field strains of fowlpox viruses have shown some significant differences. The virus is present in large numbers in the lesions and is usually transmitted by contact through abrasions of the skin. Skin lesions (scabs) shed from the recovering birds in poultry houses can become a source of aerosol infection. Mosquitos and other biting insects may serve as mechanical vectors. Transmission within flocks is rapid when mosquitos are plentiful. Some affected birds may become carriers, and the disease may be reactivated by stress (eg, moulting) or by immunosuppression due to other infections. The disease tends to persist for extended periods in multiple-age poultry complexes.
Clinical Findings
Only a few birds develop lesions at one time. Lesions are prominent in some birds and may significantly decrease flock performance. The cutaneous form is characterized by nodular lesions on various parts of the unfeathered skin of chickens and on the head and upper neck of turkeys. Generalized lesions of feathered skin may also be seen. In some cases, lesions are limited chiefly to the feet and legs. The lesion is initially a raised, blanched, nodular area that enlarges, becomes yellowish, and progresses to a thick, dark scab. Multiple lesions usually develop and often coalesce. Lesions in various stages of development may be found on the same bird. Localization around the nostrils may cause nasal discharge. Cutaneous lesions on the eyelids may cause complete closure of one or both eyes.

Scab-like
lesion, fowlpox, laying hen [!?!?!?]
this fowl has an erect comb like a male (Elio Corti)
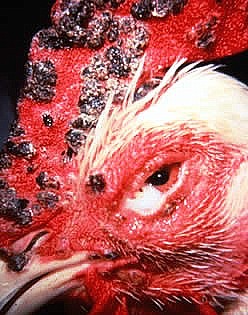
Scab-like lesion, fowlpox, broiler breeder male

Scab-like lesion, fowlpox, turkey
In the diphtheritic form, lesions develop on the mucous membranes of the mouth, esophagus, pharynx, larynx, and trachea (wetpox or fowl diphtheria). Occasionally, lesions are seen almost exclusively in one or more of these sites. Caseous patches firmly adherent to the mucosa of the larynx and mouth or proliferative masses may develop. Mouth lesions interfere with feeding. Tracheal lesions cause difficulty in respiration and may simulate infectious laryngotracheitis in chickens. Laryngeal and tracheal lesions in chickens must be differentiated from those of laryngotracheitis.
Often, the course of the disease in a flock is protracted. Extensive infection in a layer flock results in decreased egg production. Cutaneous infections alone ordinarily cause low or moderate mortality, and these flocks generally return to normal production after recovery. Mortality is usually high in the generalized or diphtheritic form.
Diagnosis
Cutaneous infections usually produce characteristic gross and microscopic lesions. When only small lesions are present, it is often difficult to distinguish them from abrasions caused by fighting. Microscopic examination of affected tissues stained with H&E reveals eosinophilic cytoplasmic inclusion bodies. Cytoplasmic inclusions are also detectable by fluorescent antibody and immunohistochemical methods. The elementary bodies in the inclusion bodies can be detected in smears from lesions stained by the Gimenez method. Viral particles with typical poxvirus morphology can be demonstrated by negative-staining electron microscopy as well as in ultrathin sections of the lesions. The virus can be isolated by inoculating chorioallantoic membrane of developing chicken embryos, susceptible birds, or cell cultures of avian origin. Chicken embryos (9-12 days old) are the preferred and most convenient host for virus isolation.
Field isolates and vaccine strains of fowlpox virus can be compared by restriction endonuclease analysis of viral genomes. This method is useful for comparing closely related DNA genomes. However, because of the large size of the genome, minor differences are difficult to detect by this method. Detailed genetic analysis reveals differences between vaccine strains and field strains responsible for outbreaks of fowlpox in previously vaccinated chicken flocks. While vaccine strains of fowlpox virus contain remnants of long terminal repeats of reticuloendotheliosis virus (REV), most field strains contain full-length REV in their genome.
Nucleic acid probes derived from cloned genomic fragments of fowlpox virus can also be used for diagnosis. This procedure is especially useful for differentiation of the diphtheritic form of fowlpox (involving the trachea) from infectious laryngotracheitis.
PCR can be used to amplify genomic DNA sequences of various sizes using specific primers. This procedure is useful when an extremely small amount of viral DNA is present in the sample. PCR has been used effectively to differentiate field and vaccine strains of fowlpox virus.
Recently, 2 monoclonal antibodies that recognize different fowlpox virus antigens have been developed. These monoclonal antibodies can be used for strain differentiation by immunoblotting.
The complete sequence of the fowlpox virus genome has been identified recently and is useful in comparing the sequences of selected genes of other avian poxviruses.
Prevention and Treatment
Where
pox is prevalent, chickens and turkeys should be vaccinated with live-embryo
or cell-culture-propagated virus. The most widely used vaccines are attenuated
fowlpox virus and pigeonpox virus isolates of high immunogenicity and low
pathogenicity. A turkeypox vaccine has been developed to control pox in turkey
flocks in which fowlpox vaccine has been ineffective. This virus appears to be
immunologically different from fowlpox virus. In high-risk areas, vaccination
with an attenuated vaccine of cell-culture origin in the first few weeks of
life and revaccination at 12-16 wk is often sufficient. Health of birds,
extent of exposure, and type of operation determine the timings of
vaccinations. Because the infection spreads slowly, vaccination is often
useful in limiting spread in affected flocks if administered when <20% of
the birds have lesions. Because passive immunity may interfere with
multiplication of vaccine virus, progeny from recently vaccinated or recently
infected flocks should be vaccinated only after passive immunity has declined.
Vaccinated birds should be examined 1 wk later for swelling and scab formation
(“take”) at the site of vaccination. Absence of “take” indicates lack
of potency of vaccine, passive or acquired immunity, or improper vaccination.
Revaccination with another serial lot of vaccine may be indicated.
Naturally infected or vaccinated birds develop humoral as well as
cell-mediated immune responses. Humoral immune responses can be measured by
ELISA or virus neutralization tests.
www.merckvetmanual.com