Vol. 1° - VII.4.
I RETROVIRUS
Virus è un vocabolo latino simile al sanscrito visha: ambedue significano veleno.
I virus sono piccolissimi parassiti intracellulari obbligati dotati di un solo tipo di acido nucleico - il core, costituito da DNA oppure da RNA - racchiuso in una struttura denominata capside, la quale è composta da proteine dette capsomeri e che talora sono ricoperte da un altro involucro, il pericapside.
Il metabolismo di un virus dipende completamente dall’ospite: un vegetale, un animale, nonché un protista, cioè un organismo unicellulare che può essere un batterio, un fungo, un’alga, un protozoo.
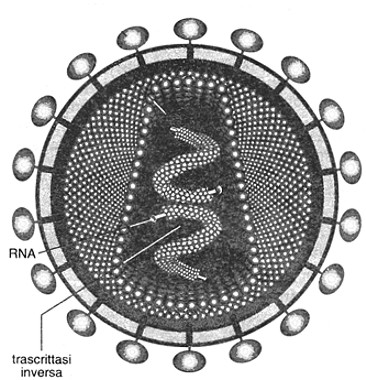
Fig. VII. 2 - Retrovirus: virus dell’HIV in sezione. La parte centrale del virus contiene l’RNA e l’enzima trascrittasi inversa che catalizza la trascrizione dell’RNA in DNA, che entra nel nucleo della cellula infettata. La maggior parte degli studiosi ritiene che questo virus sia antico quanto l’uomo e che sia originario dell’Africa centrale, inizialmente presente in alcune scimmie.
Da millenni l'uomo e il pollo vivono in simbiosi ed è difficile asserire chi dei due ha tratto maggiori vantaggi da tale convivenza. Sta di fatto che nel 1910 un agricoltore del nord dello stato di New York si recò in visita a Peyton Rous, al Rockefeller Institute di New York, e gli mostrò una gallina Plymouth Rock con un voluminoso tumore solido a carico del tessuto connettivo, un sarcoma o fibrosarcoma. Rous scoprì che inoculando alcune di quelle cellule tumorali in un soggetto Plymouth Rock sano si induceva la formazione di un tumore dello stesso tipo di quello presente nel pollo malato. Dimostrò inoltre che era possibile trasmettere tale tumore anche iniettando una soluzione filtrata - priva perciò di cellule e batteri - ottenuta da estratti della neoplasia. Il virus del sarcoma di Rous fu il primo virus oncògeno identificato come tale, ed era destinato ad avere un ruolo di primo piano nello sviluppo delle attuali conoscenze sul cancro.
Quando Ellerman e Bang e poi Rous nel corso dei loro esperimenti sui polli isolarono per la prima volta i virus oncògeni - cioè promotori di cancro - non sapevano di aver scoperto quell'importante gruppo di patogeni che circa sessant'anni dopo furono battezzati retrovirus, detti in un primo tempo virus a RNA in quanto costituiti per circa l'1% da questo nucleotide.
Negli anni Sessanta Temin avanzò l'ipotesi che, per indurre la nascita di una progenie virale da una cellula infettata da tale virus a RNA, nel corso del suo ciclo vitale il virus produceva una copia di DNA del proprio genoma, la quale a sua volta veniva trascritta dando origine all'RNA virale. Ciò trovò piena conferma quando sia Temin che Baltimore identificarono nel contesto del virus un enzima, la trascrittasi inversa, che sintetizza il DNA partendo da uno stampo di RNA: l'esatto opposto della normale trascrizione. Questa fondamentale scoperta non solo fornì informazioni precise sulle modalità di replicazione di certi virus, ma mise anche a disposizione dei biologi molecolari un nuovo e importante strumento capace di ottenere una copia di DNA da qualunque molecola di mRNA e che rappresenta un passaggio chiave nella rivoluzione degli anni Settanta: la clonazione dei geni e l'ingegneria genetica.
Quindi, il termine retrovirus non ha un'etimologia boccaccesca come le pratiche di coito anale tra gay farebbero supporre, visto che anche il virus più noto e temuto, quello dell'AIDS, appartiene alla schiera dei retrovirus e che tale è la via più frequente della sua trasmissione fra omosessuali maschi. Il nome deriva invece dagli eventi che si verificano durante la replicazione di questi virus e ai quali abbiamo in parte accennato: a partire da un genoma costituito da un singolo filamento di RNA in duplice copia e a polarità positiva, essi copiano quest'informazione in un DNA a doppia elica che a sua volta viene trascritto sintetizzando un mRNA - identico a quello del genoma - che viene poi inserito nei capsidi della progenie virale. Gli organismi che custodiscono la propria informazione genetica nel DNA - siano essi virali che non virali - utilizzano il DNA come stampo per trascrivere gli mRNA e quindi sintetizzare le proteine. Fanno eccezione solo i retrovirus, i quali si comportano andando a ritroso rispetto agli altri esseri viventi.
La maggior parte dei retrovirus conosciuti infetta i vertebrati; i retrovirus che aggrediscono il pollo, il topo, la scimmia e l'uomo sono stati studiati in modo molto accurato e sono stati suddivisi in 7 gruppi. Al primo gruppo appartengono per esempio i virus delle leucosi aviarie (ALV - che nel pollo portano a linfomi a cellule B a lunga latenza - e i virus dei sarcomi del pollo, il cui prototipo è quello del sarcoma di Rous (RSV) a latenza breve. Alcuni di questi virus vengono trasmessi orizzontalmente da un animale all'altro - virus esogeni - mentre altri, essendo trasmessi verticalmente attraverso la linea germinale, sono detti virus endogeni: qui risiede uno degli aspetti insoliti dei retrovirus in quanto, in rare occasioni, possono penetrare nella linea germinale di un animale ed insediarsi in un cromosoma dell'ospite come se costituissero un suo normale gruppo di geni. In tal caso il DNA di origine virale sarà presente negli spermatozoi o nelle cellule uovo dell'ospite e verrà trasmesso dai genitori alla prole. Tutti gli esseri umani recano nei loro cromosomi delle vestigia evolutive del DNA di retrovirus ancestrali che infettarono i nostri antenati comuni. Una situazione identica si riscontra anche nel pollo nonché in altri membri della famiglia dei Fasianidi.
È logico porsi una domanda: come fa un retrovirus ad annidarsi nel cromosoma di un ospite travestendosi con il DNA? Dopo essere penetrato nel citoplasma della cellula ospite, la trascrittasi inversa del virus sintetizza una copia del genoma virale sotto forma di DNA a doppia elica e quindi degrada l'RNA virale; il DNA a doppia elica, ancora contenuto nel capside, si muove verso il nucleo cellulare e per mezzo dell'integrasi viene integrato nel genoma della cellula ospite: a questo punto tale DNA è detto provirus, che attraverso successive tappe biochimiche porterà alla sintesi dell'RNA della progenie virale. Sembra che il sito del cromosoma dell'ospite in cui avviene l'integrazione del genoma virale - e persino quale cromosoma venga usato - rappresenti una scelta più o meno casuale, sebbene ci siano prove dell'esistenza di un gran numero di siti preferenziali.
Quindi, l'integrazione nel cromosoma rappresenta una tappa intermedia indispensabile alla replicazione di tutti i retrovirus che proprio dell'integrazione si servono per insediarsi stabilmente nell'ospite, e l'integrazione si verifica in tutte le cellule infettate dai retrovirus, in contrapposizione ai rari eventi integrativi che si osservano in cellule infettate da virus oncògeni a DNA: si tratta di un salto evolutivo davvero sofisticato nella capacità di un virus di autoriprodursi. Da notare che tutti i virus tumorali a RNA sono dei retrovirus.
Il risultato netto è che il retrovirus viene ora ereditato dalla progenie della cellula infettata. Il più delle volte i retrovirus infettano cellule somatiche e non elementi della linea germinale. Quando invece infettano spermatozoi e cellule uovo, si assiste - come già detto - alla comparsa di un virus endogeno che è trasmesso alla prole dell'ospite infettato. I retrovirus sono pertanto gli unici virus ad aver lasciato, per così dire, una traccia fossile di tipo chimico.
Alcuni retrovirus non uccidono le cellule che li ospitano, le quali, una volta infettate, continuano a produrre grandi quantità di virus per lunghi periodi di tempo. La progenie della cellula ospite infettata, costituita da cellule recanti il provirus nel loro DNA, continuerà anch'essa a produrre molte particelle virali. Altri retrovirus invece alterano le proprietà della cellula ospite, e quei virus portatori di oncogéni - cioè di geni in grado di tramutare una cellula normale in cellula tumorale - possono trasformare in vitro le cellule infettate oppure indurre l'insorgenza di tumori in vivo. Tuttavia, un terzo gruppo di retrovirus, tra i quali è compreso quello dell'AIDS - che però, secondo Peter Duesberg (1996), non sarebbe assolutamente colpevole di questa gravissima malattia -, uccide la cellula ospite servendosi di meccanismi non ancora ben definiti.
Complesso leucosi-sarcoma è un termine comprensivo di un gruppo di malattie neoplastiche ad eziologia virale che interessano i volatili, soprattutto il pollo, la maggior parte delle quali è caratterizzata da proliferazione abnorme degli elementi morfologici del sangue che si accumulano in forme immature negli organi emolinfopoietici e in altri tessuti, essendo perciò generalmente aleucemiche; ciononostante molti dei virus delle leucosi sono in grado di provocare altri tipi di leucosi nonché altri tumori del tessuto connettivale, come per esempio i sarcomi.
Gli agenti causali del complesso leucosi-sarcoma appartengono alla famiglia Retroviridae, sottofamiglia Oncovirinae, il cui gruppo d'appartenenza è detto gruppo leucosi-sarcoma oppure RNA-oncovirus aviari. La classificazione abituale di questi virus è in sottogruppi e si basa sulle proprietà del pericapside o envelope, cioè del rivestimento più esterno del virione. I retrovirus del gruppo leucosi-sarcoma aviari che infettano i polli domestici possono così essere suddivisi in 5 sottogruppi: A-B-C-D-E. I virus appartenenti ad uno stesso sottogruppo interferiscono l'uno con l'altro e infettano cellule o polli dello stesso fenotipo. Molti polli hanno nel genoma delle loro cellule una parte o tutte le informazioni genetiche per i virus del sottogruppo E i quali, pertanto, sono dei virus endogeni.
La presenza di un genoma virale completo nelle cellule normali del pollo fu dimostrata nel 1971 (Vogt & Friis, Weiss et al.). Tale retrovirus endogeno è detto Rous-associated virus-0 (RAV-0) e si è giunti alla conclusione che tutti i polli domestici contengono geni correlati al genoma di RAV-0, sia espressi che non espressi.
Nel 1972 Weiss e Biggs dimostrarono che le cellule germinali del Gallo rosso della giungla contengono il genoma di un retrovirus endogeno, integrato nei suoi cromosomi, trasmesso geneticamente e indistinguibile da quello del pollo domestico, anzi, che tali genomi virali endogeni del pollo domestico e del Gallo rosso avevano un'origine comune.
Esperimenti di ibridazione molecolare condotte dal 1973 al 1976 hanno messo in luce che sequenze di DNA correlate con RAV-0 sono endogene in altre specie di Galliformi, e hanno pure portato a concludere che le sequenze del genoma di tali Galliformi, che sono correlate con quelle del genoma di RAV-0, sono andate incontro a divergenza - insieme agli altri geni cellulari - durante l'evoluzione dei Galliformi.
Ma Frisby & Weiss hanno addotto osservazioni in contrasto con tale interpretazione. Questi studiosi hanno esaminato il DNA delle 4 specie di Galli della giungla tra loro strettamente correlati e il DNA di altri Galliformi: le sequenze di RAV-0 nel Gallo Rosso sono strettamente correlate con quelle del pollo domestico, mentre non hanno potuto mettere in evidenza delle sequenze RAV-0 correlate sia nel DNA del sonnerati che in quello del lafayettei e del varius. Con analisi più rigorosa si è potuto appurare che sequenze di DNA omologhe a quelle di RAV-0 - e dotate dell'80% di omologia - erano presenti solamente nel genoma del pollo domestico e del Gallus gallus. Il DNA del sonnerati e del varius, nonché quello del Fagiano dal collare e della Quaglia giapponese, contenevano delle sequenze dotate solamente del 10% di omologia con RAV-0.
Questi risultati mostrerebbero che durante l'evoluzione dei Phasianidae le sequenze RAV-0 correlate non sono andate incontro a divergenza congiuntamente ai normali geni dell'ospite. Inoltre, sebbene le sequenze RAV-0 siano endogene in tutti i polli domestici e nel Gallo rosso, si può tuttavia dedurre che il genoma di RAV-0 è stato introdotto piuttosto recentemente nella linea germinale di Gallus gallus per via infettiva, dopo la sua speciazione - e quindi dopo la sua separazione dalle altre specie selvatiche - ma prima della sua domesticazione, nonché indipendentemente dalle sequenze correlate riscontrate in membri del genere Phasianus.
Frisby e Weiss sono tuttavia prudenti, in quanto ammettono che non si può escludere un fatto: nelle altre 3 specie selvatiche di Gallus potrebbe essersi verificata l'intera delezione del genoma virale. Ma gli studiosi sono dell'avviso che l'ingresso del virus sia avvenuto non tanto attraverso un antenato, bensì che si sia verificato piuttosto recentemente - evoluzionisticamente parlando - e che sia giunto non da un antenato comune alle 4 specie di Gallus bensì da una fonte esterna a tali specie. L’ingresso potrebbe essere avvenuto un milione d’anni fa.
Essendo RAV-0 strettamente imparentato con i virus delle leucosi del pollo trasmesse per via infettiva - cioè orizzontale o esogena - si può pensare che RAV-0 in un primo tempo infettò Gallus gallus dopo la speciazione e prima della domesticazione, e che questo virus è stato il progenitore sia dei virus delle leucosi esogene del pollo, sia degli elementi genetici virali trasmessi attraverso la linea germinale. Nel Gallo rosso le sequenze RAV-0 correlate sono più numerose che nel pollo domestico (3-4 copie per genoma aploide contro 1-2 copie) e si trovano integrate a livello di diversi siti cromosomici.
Nel pollo domestico non è ancora chiaro in quale punto sia indovato RAV-0: per alcuni non è stato ancora mappato e si troverebbe su macrocromosomi grandi, per altri corrisponderebbe al locus ev-2 del braccio lungo del cromosoma 2 (Tereba, 1981). Di certo si trova su macrocromosomi, mentre per esempio una sequenza correlata con il gene necessario per la trasformazione e l'attività tumorigena del virus del sarcoma aviario - il gene src, acronimo di sarcoma - è localizzata su microcromosomi dei polli normali, ed è anche presente nel DNA di una gran varietà di organismi, compresi gli esseri umani.
Questi dati aprono nuove prospettive qualora si voglia determinare le origini del pollo domestico, e dimostrano che esso condivide qualcosa col Gallo Rosso della giungla, e di questo nessuno pare dubitare.
Le razze domestiche implicate nello studio sono state un ceppo di Livorno francese e la Nana di Giava della World Pheasant Association. Se si fossero studiate razze discendenti dal Giganteus o dall’Asiatico, i risultati sarebbero stati identici?