Vol. 2° - I.2.
Alcuni composti inorganici
2.1. Ossidi
Gli ossidi sono i composti
binari dell’ossigeno, contengono cioè l’ossigeno e un solo altro
elemento. Gli ossidi vengono rappresentati ponendo il simbolo dell’ossigeno
dopo quello dell’altro elemento, con l’unica eccezione di OF2
o fluoruro d’ossigeno, in quanto il fluoro è l’unico elemento più
elettronegativo dell’ossigeno. Si segue infatti la regola generale di porre
per ultimo l’elemento più elettronegativo.
Gli ossidi che in seguito a trattamento con acqua danno
origine agli idrossidi sono detti ossidi basici o semplicemente ossidi; quelli
che invece danno origine agli ossiacidi son detti ossidi acidi o anidridi.
2.2. Perossidi
I perossidi sono particolari
composti caratterizzati da un legame covalente tra due atomi di ossigeno.
Classico esempio è il perossido d’idrogeno o acqua ossigenata, dalla
formula H2O2.
2.3. Idrossidi
Gli idrossidi sono composti che
si possono ottenere per addizione di acqua agli ossidi. Sostanze di impiego
comune sono l’idrossido di sodio NaOH e l’idrossido di calcio Ca(OH)2.
2.4. Ioni positivi o cationi
La formula di uno ione metallico
si scrive ponendo in alto e a destra del simbolo dell’elemento tante cariche
positive quante ne indica il numero di ossidazione. Ecco un esempio che avremo
modo di utilizzare in seguito: Fe2+
ione ferroso Fe3+ ione ferrico.
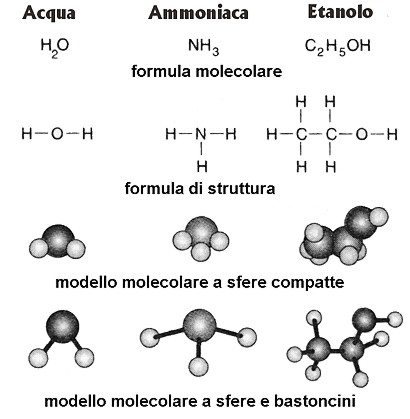
Fig.I. 3 - Formule chimiche di composti inorganici e organici
2.5. Acidi ossigenati
I composti di questa categoria,
detti anche ossiacidi, possono
essere ottenuti per addizione di acqua alle relative anidridi. La formula di
un acido viene rappresentata scrivendo nell’ordine i simboli dell’idrogeno,
dell’elemento che dà il nome all’acido, e quindi dell’ossigeno,
ciascuno di essi accompagnato da un indice che rappresenta il numero di atomi
di quella specie contenuti nella molecola dell’acido. Così l’acido
nitrico ha la formula HNO3 e l’acido solforico H2SO4.
2.6. Composti binari idrogenati
L’idrogeno si lega con
numerosi metalli dando luogo a composti detti idruri.
Se l’idrogeno si lega con gli alogeni si ha la formazione degli idracidi, un
cui rappresentante, importantissimo per la digestione gastrica, è l’acido
cloridrico, con formula HCl.
2.7. Ioni negativi o anioni
Se ad un acido vengono tolti
ioni idrogeno H+, si ottiene uno ione negativo,
o anione, in quanto migra verso l’anodo,
e reca tante cariche negative quanti sono gli ioni idrogeno che sono stati
eliminati. Lo ione solfato derivante dall’acido solforico per perdita di due
atomi di idrogeno viene rappresentato così: SO
2.8. Sali
I sali sono composti di natura ionica che possono essere preparati per reazione tra l’ossido, l’idrossido di un metallo o il metallo stesso, con uno dei composti derivanti da un non metallo, come un’anidride, un acido o lo stesso non metallo. Un sale sarà perciò costituito da una parte metallica, che si identifica con lo ione del metallo, da una parte non metallica, che si identifica con l’anione dell’acido. Un sale per antonomasia è il cloruro di sodio NaCl.