Vol. 2° - XIX.11.1.
Emoglobina e mioglobina
L’evoluzione dell’emoglobina
e della mioglobina è un esempio classico in cui si pensa che essa si sia
verificata attraverso un processo rappresentato da successive duplicazioni del gene. Ambedue queste molecole proteiche sono importanti per il
trasporto dell’ossigeno nei vertebrati: l’emoglobina, contenuta nei
globuli rossi nella quantità di 280 milioni di molecole per eritrocita,
assicura il trasporto dell’ossigeno dai polmoni ai tessuti; la mioglobina
rappresenta una riserva di ossigeno prevalentemente per il muscolo
scheletrico.
Nell’uomo,
la forma predominate di emoglobina
dell’adulto è rappresentata da due coppie di catene polipeptidiche,
a e b globina, costituite ognuna da
due subunità di catene polipeptidiche uguali (quindi a1
e a2
- b1
e b2),
ma esistono anche delle piccole quantità di varianti dell’emoglobina
normale, che finora assommano a 90. Altre forme di emoglobina sono presenti
nel feto (forma g) e nell’embrione durate le
primissime fasi di sviluppo (forma e).
Nelle specie di mammiferi e di uccelli in cui finora l’emoglobina
è stata esaminata, è possibile assegnare le catene di globina a uno dei due
tipi base, a
e b. La suddivisione si basa sul
grado di omologia tra la globina in questione e il tipo a oppure b, e si pensa che tale omologia
rifletta la loro origine evoluzionistica.
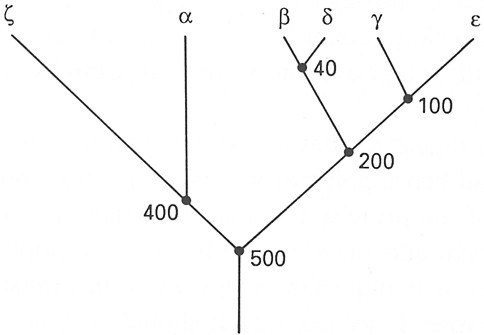
Fig.
XIX. 9 –
Probabili relazioni evoluzionistiche delle globine umane a
b,
g,
d,
e
e z
I numeri indicano i milioni di anni dall’inizio della divergenza.
Si è dell’avviso
che a ogni punto delle ramificazioni si sia verificata una duplicazione
genica.
Nell’uomo il tipo
b
comprende le globine b,
g, d ed e, mentre il tipo a
comprende le globine a
e z. Si pensa che le globine
appartenenti al tipo a
siano andate incontro a divergenza 400 milioni d’anni fa, prima del distacco
di mammiferi e uccelli dai rettili, mentre le globine del tipo b hanno subito lo stesso processo
di divergenza circa 200 milioni d’anni fa, contemporaneamente al distacco
filogenetico dei mammiferi e degli uccelli.
Nel
pollo domestico esistono due forme principali di emoglobina
adulta, A e D, HbA
70% e HbD 30%, nonché due forme minori, H
e L, HbH
- HbL presenti in tracce. Come nel
caso dei mammiferi, esistono almeno 3 forme di emoglobina embrionale, presenti
nei globuli rossi che si sviluppano nel sacco vitellino fino al 5° giorno d’incubazione.
Tra il 5° e il 12° giorno le cellule embrionali della serie rossa vengono
gradualmente sostituite da eritrociti normali contenenti emoglobina adulta.
Recentemente sono stati scoperti altri tipi di globine che appartengono al
tipo a
oppure al tipo b e queste catene vengono
codificate da due
famiglie multigeniche.
Una famiglia multigenica consiste in un gruppo di geni tra loro correlati, e
raggruppati tra loro su particolari cromosomi. Si pensa che questi geni siano
derivati da successive
duplicazioni geniche verificatesi durante la meiosi a causa di un
crossingover ineguale. Un buon numero di famiglie multigeniche è stato
identificato, e i geni delle globine appartenenti al tipo b sono stati mappati usando una
banca genomica
[1]
del pollo domestico.
Le famiglie geniche per la globina sono spesso considerate
come un paradigma nello studio dell’espressione
genica regolata dallo sviluppo dell’organismo.
I globuli rossi degli uccelli sono particolarmente utili sotto questo profilo
in quanto presentano degli stadi di sviluppo ben definiti nella loro
successione. Dal momento che anche il tipo a
della globina è stato sottoposto a sequenziamento, è possibile studiare in
modo dettagliato la regolazione dipendente dallo sviluppo.
L’espressione genica dipende in primo luogo dalla trascrizione, e questo fatto richiede l’unione della RNA polimerasi ai siti promotori adiacenti al gene. In questo punto esistono anche delle sequenze di DNA poste al di fuori della regione del promotore, note come enhancers, in grado di incrementare la velocità di trascrizione, e sono spesso molto importanti nella regolazione genica durante il processo di sviluppo dell’organismo, e possono essere specifici a seconda dei tipi di tessuto. Sono in grado di agire a distanza, cioè non hanno bisogno di essere adiacenti al gene, e possono essere localizzati dal lato 5’ oppure 3’ del gene stesso.
Gli enhancers interagiscono con proteine specifiche, e si pensa che in
qualche modo rendano il gene più accessibile alla RNA polimerasi. Si è visto
che gli enhancers sono adiacenti ad
ambedue le famiglie per a
e b globina, localizzate su
cromosomi differenti: sul cromosoma 1 o 2 la famiglia a, su un piccolo macrocromosoma o
forse su un microsoma grande la famiglia b.
Inoltre, considerando l’evoluzione di un particolare gruppo di proteine in
seno a una specie, è possibile tessere delle relazioni tra gli stadi
evoluzionistici in seno alla specie nei confronti dell’evoluzione e della
divergenza di specie, di generi e di famiglie fra loro.
Si pensa che la catena di e
globina si sia evoluta dalla b
globina per duplicazione genica. In base alle differenze tra gli aminoacidi di
queste globine, il gene della e
globina del pollo domestico si è evoluto sin dal momento dell’origine della
classe degli uccelli, e nei mammiferi le globine di tipo e si sono evolute dal loro tipo b in modo indipendente.
Il
pollo domestico è alquanto insolito per il fatto di possedere due tipi di globine
a,
aA
e aD,
ciascuna presente in discreta quantità. La globina aD
è presente nel nandù, nello struzzo, nel fagiano, nel passero, nell’oca
selvatica e nel condor delle Ande, mentre altre specie di uccelli, come
pinguino, egretta, piccione, cuculo e parrocchetti non posseggono la globina aD,
assente anche nei mammiferi. Si pensa che gli uccelli che non presentano la
globina aD
hanno perso la capacità di esprimere il relativo gene, espresso precocemente
nei loro antenati. Non è certo se questa emoglobina sia essenziale nel pollo
domestico. Sta di fatto che negli ultimi stadi embrionali l’emoglobina aD
è presente in proporzioni più elevate rispetto all’adulto e che la
presenza dell’emoglobina aD
aumenta l’affinità del sangue per l’ossigeno.
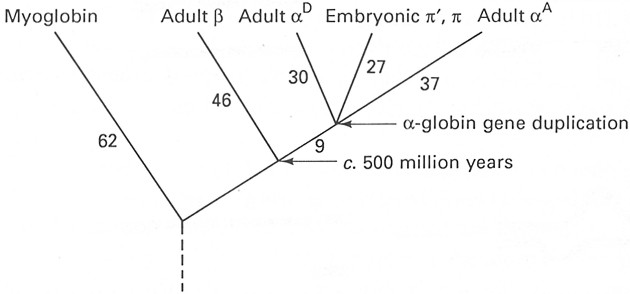
Fig. XIX. 10 – Evoluzione delle globine - mioglobina ed emoglobina - nel pollo domestico.
Nonostante la mioglobina sia stata sottoposta a sequenziamento in molte specie di vertebrati, è stata studiata secondo lo stesso principio solo in due specie di uccelli: pollo domestico e Pinguino imperatore, Aptenodytes forsteri. Pertanto al momento attuale non abbiamo informazioni sufficienti, basate su questa sostanza, allo scopo di chiarire l’evoluzione in seno alla classe degli uccelli. Nel caso delle emoglobine è possibile non solo paragonare le sequenze aminoacidiche, ma anche le sequenze dei nucleotidi, dal momento che i dati sulle sequenze sono disponibili da un elevato numero di globine a e b, come pure da un certo numero di pseudogèni [2] della globina.
Così diventa possibile paragonare il numero di cambiamenti a
carico della sequenza nucleotidica, che si manifesta in un cambiamento nella
sequenza degli aminoacidi, con il numero di mutazioni che non provocano alcun
cambiamento, che sono le cosiddette sostituzioni
silenti. I dati a disposizione depongono per una prevalenza di mutazioni
nella sequenza nucleotidica con mutazione nella sequenza aminoacidica rispetto
alle sostituzioni silenti. Tutto
ciò conforta la teoria secondo cui l’evoluzione della globina è il
risultato di una selezione naturale che si è svolta su mutazioni di geni
duplicati, e si contrappone alla visione neutralista secondo cui una deriva
genetica casuale sarebbe responsabile del cambiamento nella sequenza
aminoacidica.