Lessico
Lebbra

Lebbroso con campanella
in un manoscritto del XIV secolo.
In Francia dovevano avere con sé la tartarelle
che dovevano suonare quando
uscivano in strada
per farsi riconoscere e così la gente si scostasse a debita distanza.
La tartarelle è quella tavoletta di legno a percussione metallica
detta
tabella o tarabaccola
che si suonava negli ultimi 3 giorni della Settimana
Santa
quando le campane tacevano.
La
lebbra a Bologna
nel 1014
grazie al gallo risorto
Pare che
nel territorio di Bologna intorno al 1014 una lebbra vera, dovuta cioè al Mycobacterium
leprae, oppure una patologia etichettata come lebbra ma dovuta a
tutt'altra causa, abbia colpito due fratelli e la loro discendenza. Ciò
avvenne con l'intercessione di San Pietro e grazie a un gallo che prima di
resuscitare li aveva indotti a un sacrilegio
di tracotanza blasfema. La fonte è San Pier Damiani![]() (1007-1072) che a sua volta ne era stato informato da un diacono assennato e
stimato. Ecco cosa ci riferisce in merito Ulisse Aldrovandi a pagina 247
(1007-1072) che a sua volta ne era stato informato da un diacono assennato e
stimato. Ecco cosa ci riferisce in merito Ulisse Aldrovandi a pagina 247![]() di Ornithologiae
tomus alter (1600):
di Ornithologiae
tomus alter (1600):
Il
dottissimo e mio grande amico Carlo Sigonio![]() racconta
con le seguenti parole un miracolo quasi uguale - a quello del gallo e della
gallina resuscitati a Santo Domingo de la Calzada
racconta
con le seguenti parole un miracolo quasi uguale - a quello del gallo e della
gallina resuscitati a Santo Domingo de la Calzada![]() -
traendolo da San Pier Damiani a proposito di un gallo cotto e tagliato a
pezzi, e messo su una mensa per essere mangiato: In verità, quando se ne
presenta l’occasione, un certo scrupolo mi trattiene dal passare sotto
silenzio, come se fossero da disprezzare, quelle cose che persone sante o
virtuose ritennero di dover essere dedicate ai posteri come avvenimenti
importanti. Per cui dal momento che durante questi anni, stando a San Pier
Damiani contemporaneo a tale periodo (intorno all’anno 1014), è stato
compiuto un grande prodigio da San Pietro Apostolo in seno alla comunità dei
fedeli di Bologna, ho ritenuto che non dovessi tacerlo. Quello che riferisco,
egli dice, l’ho appreso dal racconto di un certo diacono assennato e oggetto
di stima da parte di questa generazione. Due uomini che si trattenevano dalle
parti di Bologna sia per un vincolo di amicizia che, se ci rifletto bene, per
il legame derivante dal fatto di avere il padre in comune, se ne stavano
sdraiati a un banchetto: fu portato loro in tavola un gallo. Naturalmente uno
di loro, preso un piccolo coltello, come è consuetudine tagliò a pezzi
quella portata e vi versò sopra anche del pepe tritato insieme
all’intingolo. Fatto ciò, l’altro subito dice: Confratello, hai senza
dubbio squartato un gallo in un modo tale che lo stesso San Pietro, anche se
lo volesse, non riuscirebbe a rimetterlo insieme. L’altro subito gli replicò:
Certamente, non solo San Pietro, ma se anche lo comandasse Cristo in persona,
costui non risorgerà mai più. A queste parole improvvisamente il gallo
schizzò in piedi vivo e ricoperto di piume, agitò le ali e cantò e spruzzò
tutto l’intingolo sui commensali. Immediatamente un’adeguata pena di
castigo fa seguito al sacrilegio di tracotanza blasfema: infatti durante
l’aspersione del pepe furono colpiti dalla lebbra, e naturalmente dovettero
sopportare questa calamità non solo essi stessi fino alla morte, ma la
tramandarono anche ai loro posteri per tutte le generazioni come se fosse
un’eredità. Per cui avvenne che sono stati inseriti tra la servitù della
santa Chiesa bolognese, che appunto è stata insignita del titolo di San
Pietro Apostolo. Come ha affermato il narratore, la loro progenie tuttora
affetta da lebbra è stata registrata con l’imposta annua di un duro
tributo, affinché forniscano con la propria attività manuale i setacci alla
Chiesa. Senza dubbio così, sottoposti ai supplizi di una duplice pena, della
lebbra e della schiavitù, insegnano agli altri di non parlare mai della
potenza divina senza riflettere. E il gallo, che da tempo aveva dimostrato che
Pietro mentre si trovava sulla terra era un rinnegato, in quel momento fornì
la prova che regnava in cielo con colui che aveva rinnegato.
-
traendolo da San Pier Damiani a proposito di un gallo cotto e tagliato a
pezzi, e messo su una mensa per essere mangiato: In verità, quando se ne
presenta l’occasione, un certo scrupolo mi trattiene dal passare sotto
silenzio, come se fossero da disprezzare, quelle cose che persone sante o
virtuose ritennero di dover essere dedicate ai posteri come avvenimenti
importanti. Per cui dal momento che durante questi anni, stando a San Pier
Damiani contemporaneo a tale periodo (intorno all’anno 1014), è stato
compiuto un grande prodigio da San Pietro Apostolo in seno alla comunità dei
fedeli di Bologna, ho ritenuto che non dovessi tacerlo. Quello che riferisco,
egli dice, l’ho appreso dal racconto di un certo diacono assennato e oggetto
di stima da parte di questa generazione. Due uomini che si trattenevano dalle
parti di Bologna sia per un vincolo di amicizia che, se ci rifletto bene, per
il legame derivante dal fatto di avere il padre in comune, se ne stavano
sdraiati a un banchetto: fu portato loro in tavola un gallo. Naturalmente uno
di loro, preso un piccolo coltello, come è consuetudine tagliò a pezzi
quella portata e vi versò sopra anche del pepe tritato insieme
all’intingolo. Fatto ciò, l’altro subito dice: Confratello, hai senza
dubbio squartato un gallo in un modo tale che lo stesso San Pietro, anche se
lo volesse, non riuscirebbe a rimetterlo insieme. L’altro subito gli replicò:
Certamente, non solo San Pietro, ma se anche lo comandasse Cristo in persona,
costui non risorgerà mai più. A queste parole improvvisamente il gallo
schizzò in piedi vivo e ricoperto di piume, agitò le ali e cantò e spruzzò
tutto l’intingolo sui commensali. Immediatamente un’adeguata pena di
castigo fa seguito al sacrilegio di tracotanza blasfema: infatti durante
l’aspersione del pepe furono colpiti dalla lebbra, e naturalmente dovettero
sopportare questa calamità non solo essi stessi fino alla morte, ma la
tramandarono anche ai loro posteri per tutte le generazioni come se fosse
un’eredità. Per cui avvenne che sono stati inseriti tra la servitù della
santa Chiesa bolognese, che appunto è stata insignita del titolo di San
Pietro Apostolo. Come ha affermato il narratore, la loro progenie tuttora
affetta da lebbra è stata registrata con l’imposta annua di un duro
tributo, affinché forniscano con la propria attività manuale i setacci alla
Chiesa. Senza dubbio così, sottoposti ai supplizi di una duplice pena, della
lebbra e della schiavitù, insegnano agli altri di non parlare mai della
potenza divina senza riflettere. E il gallo, che da tempo aveva dimostrato che
Pietro mentre si trovava sulla terra era un rinnegato, in quel momento fornì
la prova che regnava in cielo con colui che aveva rinnegato.
Non
sappiamo se il diacono e San Pier Damiani conoscessero la lebbra per
esperienza diretta in quanto già presente in Italia, oppure ne avessero
notizia solo attraverso le Sacre Scritture. Di qualunque tipo di lebbra si
trattasse, senz'altro anche questa del 1014 rispondeva a un particolare
criterio che è rimasto invariato nei secoli: secondo i Vangeli si trattava di
una malattia che la misericordia e l'onnipotenza di Cristo erano in grado di
guarire in un battibaleno. Il termine greco lépra lo troviamo in tutti
e tre gli evangelisti che tramandano il miracolo di Cristo sul lebbroso:
Matteo, Marco e Luca. Il dizionario di greco puntualizza che questo vocabolo
deriva da leprós, scaglioso, scabro, aspro, a sua volta dal verbo lépø
= togliere la pelle o la scorza, sbucciare, pelare. Aggiunge inoltre che lépra
è un tipo di scabbia (asperità, rugosità), ma che si tratta di una malattia
della pelle non identificata, e che per esempio Ippocrate![]() , Erodoto
, Erodoto![]() ,
Teofrasto
,
Teofrasto![]() e Galeno
e Galeno![]() usarono lépra
volendo esprimere una malattia cutanea in senso lato in grado di causare una
pelle rugosa, ma ovviamente non erano ancora in grado di sapere di cos'era
capace un microrganismo. Vediamo gli evangelisti.
usarono lépra
volendo esprimere una malattia cutanea in senso lato in grado di causare una
pelle rugosa, ma ovviamente non erano ancora in grado di sapere di cos'era
capace un microrganismo. Vediamo gli evangelisti.
Matteo 8:1-3: [1] Quando Gesù fu sceso dal monte, molta folla lo seguiva. [2] Ed ecco venire un lebbroso e prostrarsi a lui dicendo: "Signore, se vuoi, tu puoi sanarmi". [3] E Gesù stese la mano e lo toccò dicendo: "Lo voglio, sii sanato". E subito la sua lebbra scomparve.
Marco 1:39-42: [39] E andò per tutta la Galilea, predicando nelle loro sinagoghe e scacciando i demòni. [40] Allora venne a lui un lebbroso: lo supplicava in ginocchio e gli diceva: "Se vuoi, puoi guarirmi!". [41] Mosso a compassione, stese la mano, lo toccò e gli disse: "Lo voglio, guarisci!". [42] Subito la lebbra scomparve ed egli guarì.
Luca 5:12-13: [12] Un giorno Gesù si trovava in una città e un uomo coperto di lebbra lo vide e gli si gettò ai piedi pregandolo: "Signore, se vuoi, puoi sanarmi". [13] Gesù stese la mano e lo toccò dicendo: "Lo voglio, sii risanato!". E subito la lebbra scomparve da lui.
Come contropartita al fatto che la misericordia e l'onnipotenza di Cristo
erano in grado di guarire un lebbroso in un battibaleno, anche nella Chiesa
Cattolica si radicò l'idea che un lebbroso è un essere immondo, per cui
andava isolato in un lazzaretto sotto gli auspici di un inesistente San
Lazzaro![]() , forse non solo per motivi igienici, ma anche, o soprattutto, per
ragioni morali. Responsabile della seconda motivazione potrebbe essere San
Marco, che è l'unico a far precedere la folgorante guarigione del lebbroso
dal fatto che Gesù oltre a predicare stava scacciando i demoni.
, forse non solo per motivi igienici, ma anche, o soprattutto, per
ragioni morali. Responsabile della seconda motivazione potrebbe essere San
Marco, che è l'unico a far precedere la folgorante guarigione del lebbroso
dal fatto che Gesù oltre a predicare stava scacciando i demoni.
Lazzaretto o lazzeretto era il nome degli ospedali in cui un tempo venivano curati i lebbrosi, detti Lazzeri, nel senso di poveri uomini, accostandoli a Lazzaro di cui si parla in una parabola del Vangelo di Luca contrapponendolo al ricco Epulone, ambedue escogitati da Cristo a scopo propedeutico. Tralasciamo volutamente la complessa e incerta etimologia di lazzaretto che pare comporti la fusione di Lazzaro con Nazareth. Fatto sta che Lazzaro divenne il patrono dei lebbrosi e degli appestati, intendendosi per appestati coloro che erano affetti non solo da peste ma da una qualunque malattia contagiosa. Bella trovata terapeutica quella di affidare malati con poche speranze di vita a un santo inesistente! Poteri della fede e della creatività umana.
Ma attenti alla data del 1182. San Lazzaro, cui si ricollega lazzaretto,
è un'isola della Laguna Veneta![]() (26.000 mq e 31 abitanti, divenuta San Lazzaro degli Armeni nel 1717)
che si trova poco a ovest del Lido di Venezia. Fu così denominata nel 1182
per onorare e supplicare San Lazzaro, allorché divenne un asilo per i
lebbrosi, in contropartita a una primitiva sede a san Trovaso
(26.000 mq e 31 abitanti, divenuta San Lazzaro degli Armeni nel 1717)
che si trova poco a ovest del Lido di Venezia. Fu così denominata nel 1182
per onorare e supplicare San Lazzaro, allorché divenne un asilo per i
lebbrosi, in contropartita a una primitiva sede a san Trovaso![]() che risultava troppo poco isolata rispetto ai Veneziani in buona salute.
Dopo secoli di abbandono, nel 1717 la Repubblica di Venezia fece dono
dell'isola a Pietro Manuk, detto Mekhitar
che risultava troppo poco isolata rispetto ai Veneziani in buona salute.
Dopo secoli di abbandono, nel 1717 la Repubblica di Venezia fece dono
dell'isola a Pietro Manuk, detto Mekhitar![]() , che vi fondò un convento divenuto ben presto il centro principale
della civiltà armena in Occidente, con una ricca biblioteca e documenti di
grande interesse storico.
, che vi fondò un convento divenuto ben presto il centro principale
della civiltà armena in Occidente, con una ricca biblioteca e documenti di
grande interesse storico.
Lazzaro, anche se frutto di fantasia, veniva festeggiato come santo il 21 giugno insieme a Luigi Gonzaga, e nei secoli è rimasto simbolo degli uomini poveri e mendicanti nonché coperti di piaghe, in contrapposizione con quelli ricchi e sani come Epulone (da epulum che in latino significa banchetto solenne, quindi persona dedita ai piaceri della mensa), il quale oltre a essere ricco era anche felice, continuando a gozzovigliare fino alla morte, quando le sorti sue e di Lazzaro si invertirono.
Per completezza aggiungiamo che nell'antica Roma un epulone (epulo,
epulonis) era un membro del collegio sacerdotale istituito nel 196 aC con
la funzione di accudire a due banchetti sacri (epula Iovis) che avevano
luogo annualmente il 13 settembre e il 13 novembre. Ma Cicerone![]() usò il termine epulone anche nel senso di crapulone, beone, ed è
logico: chi mangia tanto deve trangugiare liquidi in abbondanza. Nel testo
greco del Vangelo non esiste Epulone: costui era definito come un uomo che
quotidianamente si rallegrava in modo splendido, euphrainómenos lamprôs,
per cui l'etimologia e il significato traslato di epulone si basano sulla
traduzione latina.
usò il termine epulone anche nel senso di crapulone, beone, ed è
logico: chi mangia tanto deve trangugiare liquidi in abbondanza. Nel testo
greco del Vangelo non esiste Epulone: costui era definito come un uomo che
quotidianamente si rallegrava in modo splendido, euphrainómenos lamprôs,
per cui l'etimologia e il significato traslato di epulone si basano sulla
traduzione latina.
Ecco la parabola riferita da Luca, dove per correttezza converrebbe
sostituire "banchettava lautamente" (desumibile da ciò che
viene appresso, in quanto Lazzaro si sfamava con ciò che cadeva dalla mensa
del ricco) con "si rallegrava in modo splendido". Ma euphrainómenos lamprôs nella Vulgata![]() viene appunto tradotto con epulabatur splendide.
viene appunto tradotto con epulabatur splendide.
XVI - [19] C'era un uomo ricco, che vestiva di porpora e di bisso e tutti i giorni banchettava lautamente. [20] Un mendicante, di nome Lazzaro, giaceva alla sua porta, coperto di piaghe, [21] bramoso di sfamarsi di quello che cadeva dalla mensa del ricco. Perfino i cani venivano a leccare le sue piaghe. [22] Un giorno il povero morì e fu portato dagli angeli nel seno di Abramo. Morì anche il ricco e fu sepolto. [23] Stando nell'inferno tra i tormenti, levò gli occhi e vide di lontano Abramo e Lazzaro accanto a lui. [24] Allora gridando disse: Padre Abramo, abbi pietà di me e manda Lazzaro a intingere nell'acqua la punta del dito e bagnarmi la lingua, perché questa fiamma mi tortura. [25] Ma Abramo rispose: Figlio, ricordati che hai ricevuto i tuoi beni durante la vita e Lazzaro parimenti i suoi mali; ora invece lui è consolato e tu sei in mezzo ai tormenti. [26] Per di più, tra noi e voi è stabilito un grande abisso: coloro che di qui vogliono passare da voi non possono, né di costì si può attraversare fino a noi. [27] E quegli replicò: Allora, padre, ti prego di mandarlo a casa di mio padre, [28] perché ho cinque fratelli. Li ammonisca, perché non vengano anch'essi in questo luogo di tormento. [29] Ma Abramo rispose: Hanno Mosè e i Profeti; ascoltino loro. [30] E lui: No, padre Abramo, ma se qualcuno dai morti andrà da loro, si ravvederanno. [31] Abramo rispose: Se non ascoltano Mosè e i Profeti, neanche se uno risuscitasse dai morti saranno persuasi. (Luca 16: 19-31)
La croce dell'Ordine di San Lazzaro
Così, in memoria delle piaghe di Lazzaro, che non
si capisce se erano leccate da cani misericordiosi oppure famelici, venne
istituito l'Ordine di San Lazzaro, ordine religioso e militare fondato al
principio del sec. XII a Gerusalemme per l'assistenza ai lebbrosi.
Trasferitosi ad Acri, oggi Akko, sulla costa del Mediterraneo, raggiunse il
massimo splendore nella metà del sec. XIII, per poi decadere con la
progressiva avanzata musulmana. Dopo il sec. XV continuò a sussistere in
diversi Paesi dell'Occidente, dove godeva di sostanziosi benefici. Nel 1572
Emanuele Filiberto di Savoia, nominato Gran Maestro dell'Ordine da papa
Gregorio XIII![]() , lo riunì a quello di San Maurizio, martire del sec. III e
soldato nella legione tebea, formata solo da cristiani. L'Ordine di San
Maurizio era stato fondato nel 1434 da Amedeo VIII di Savoia in occasione del
suo ritiro nell'eremitaggio del castello di Ripaglia sulle sponde del lago di
Ginevra.
, lo riunì a quello di San Maurizio, martire del sec. III e
soldato nella legione tebea, formata solo da cristiani. L'Ordine di San
Maurizio era stato fondato nel 1434 da Amedeo VIII di Savoia in occasione del
suo ritiro nell'eremitaggio del castello di Ripaglia sulle sponde del lago di
Ginevra.

La croce dell'Ordine dei Santi Maurizio e Lazzaro
Ecco così nascere nel 1572
il pluriencomiabile Ordine dei Santi Maurizio e Lazzaro che anche a Valenza![]() ha nutrito e salvato
medici, paramedici e Pazienti a iosa, finché i politici non hanno deciso
diversamente. In Francia l'ordine di San Lazzaro resistette fino al 1600,
quando Enrico IV, sotto il pontificato di Paolo V, lo fuse con l'ordine di
Nostra Signora del Carmelo.
ha nutrito e salvato
medici, paramedici e Pazienti a iosa, finché i politici non hanno deciso
diversamente. In Francia l'ordine di San Lazzaro resistette fino al 1600,
quando Enrico IV, sotto il pontificato di Paolo V, lo fuse con l'ordine di
Nostra Signora del Carmelo.
Pare che la lebbra vera, dovuta cioè al Mycobacterium leprae, abbia fatto la sua comparsa in Europa nel II millennio. C'è chi dice nell'XI, chi nel XII o nel XIII secolo. Si afferma pure che il massimo della diffusione si ebbe al ritorno dei Crociati, i Guerrieri di Cristo voluti da Urbano II. La prima crociata (1096-1099) ebbe ufficialmente inizio il 27 novembre 1095 nella città francese di Clermont-Ferrand dove papa Urbano II, nel corso di un concilio ecclesiastico, espose il piano di una spedizione volta a liberare i Luoghi Santi, esortando i fedeli ad arruolarsi. Ma la prima crociata si concluse ben 85 anni dopo la punizione dei fratelli bolognesi. E l'isola di San Lazzaro a Venezia fu così denominata in onore di San Lazzaro nel 1182, allorché divenne un asilo per i lebbrosi, quindi 168 anni dopo la punizione dei fratelli bolognesi.
Lasciando da parte qualsiasi ironia, la lebbra scagliata da Dio su Bologna come castigo per il sacrilegio di tracotanza blasfema di due fratelli titillati da un gallo e per intercessione di San Pietro, se era dovuta al Mycobacterium leprae, come potrebbe suggerire la sua cronologia dovuta al diacono e a San Pier Damiani (1007-1072), potrebbe rappresentare il primo caso di lebbra vera europea, che solo nel XV secolo cominciò ad abbassare le ali dal punto di vista endemico.
E i Bolognesi erano molto
devoti a San Pietro: infatti l'attuale Cattedrale di San Pietro a Bologna![]() venne eretta intorno al
900, per essere più volte rimaneggiata, fino alle forme attuali che risalgono
al 1757. Certo che San Pietro potrebbe benissimo aver insegnato ai Bolognesi a
essere gente tosta, come in effetti ancor oggi sono. Non solo appestò di
lebbra i due fratelli e i figli dei loro figli, ma già a suo tempo, anche se
in uno scatto d'ira come succede a ciascuno di noi, si era concesso di
impugnare una spada e di tagliare un orecchio a Malco
venne eretta intorno al
900, per essere più volte rimaneggiata, fino alle forme attuali che risalgono
al 1757. Certo che San Pietro potrebbe benissimo aver insegnato ai Bolognesi a
essere gente tosta, come in effetti ancor oggi sono. Non solo appestò di
lebbra i due fratelli e i figli dei loro figli, ma già a suo tempo, anche se
in uno scatto d'ira come succede a ciascuno di noi, si era concesso di
impugnare una spada e di tagliare un orecchio a Malco![]() .
.
Ce lo ricorda Aldrovandi a
pagina 264![]() che si inserisce nella
protratta leccata all'Inquisizione dal titolo Mystica (Argomenti
Sacri in cui è implicato il gallo), una leccata di ben 5.565 parole
contro le 45 di Conrad Gessner, e, se non bastasse, i vocaboli di Aldrovandi
corrispondono a 1/26 di tutto il Nuovo Testamento in greco. La tagliata
d'orecchio perpetrata da San Pietro ce la tramanda San Giovanni.
che si inserisce nella
protratta leccata all'Inquisizione dal titolo Mystica (Argomenti
Sacri in cui è implicato il gallo), una leccata di ben 5.565 parole
contro le 45 di Conrad Gessner, e, se non bastasse, i vocaboli di Aldrovandi
corrispondono a 1/26 di tutto il Nuovo Testamento in greco. La tagliata
d'orecchio perpetrata da San Pietro ce la tramanda San Giovanni.
[1] Detto questo, Gesù uscì con i suoi discepoli e andò di là dal torrente Cèdron, dove c'era un giardino nel quale entrò con i suoi discepoli. [2] Anche Giuda, il traditore, conosceva quel posto, perché Gesù vi si ritirava spesso con i suoi discepoli. [3] Giuda dunque, preso un distaccamento di soldati e delle guardie fornite dai sommi sacerdoti e dai farisei, si recò là con lanterne, torce e armi. [4] Gesù allora, conoscendo tutto quello che gli doveva accadere, si fece innanzi e disse loro: "Chi cercate?". [5] Gli risposero: "Gesù, il Nazareno". Disse loro Gesù: "Sono io!". Vi era là con loro anche Giuda, il traditore. [6] Appena disse "Sono io", indietreggiarono e caddero a terra. [7] Domandò loro di nuovo: "Chi cercate?". Risposero: "Gesù, il Nazareno". [8] Gesù replicò: "Vi ho detto che sono io. Se dunque cercate me, lasciate che questi se ne vadano". [9] Perché s'adempisse la parola che egli aveva detto: "Non ho perduto nessuno di quelli che mi hai dato". [10] Allora Simon Pietro, che aveva una spada, la trasse fuori e colpì il servo del sommo sacerdote e gli tagliò l'orecchio destro. Quel servo si chiamava Malco. [11] Gesù allora disse a Pietro: "Rimetti la tua spada nel fodero; non devo forse bere il calice che il Padre mi ha dato?". [12] Allora il distaccamento con il comandante e le guardie dei Giudei afferrarono Gesù, lo legarono [13] e lo condussero prima da Anna: egli era infatti suocero di Caifa, che era sommo sacerdote in quell'anno. (Giovanni 18:1-13)
La confusione circa la storia della lebbra non ha pari. Ve ne renderete conto leggendo i relativi capitoli in italiano e in inglese contenuti nelle rispettive voci del lessico. Altrettanto confusa è la storia dei lebbrosari. Secondo Rudolph Virchow (1821-1902) nell'VIII secolo ce n'erano parecchi in Italia, come possiamo desumere dalla Catholic Encyclopedia: The historical researches of Virchow concerning leper-houses (leprosaria) have established the fact that such institutions existed in France as early as the seventh century at Verdun, Metz, Maestricht, etc., and that leprosy must even then have been widespread. In the eighth century St. Othmar in Germany and St. Nicholas of Corbis in France founded leper-houses, and many such existed in Italy. (See Virchow in "Archiv für pathologische Anatomie", XVIII-XX, Leipzig, 1860.) - For Italy we have Muratori's statement (Antiq. Ital. Med. Ævi, III, 53), "Vix ulla civitas quae non aliquem locum leprosis destinatum haberet."
Lo storico e letterato Ludovico Antonio Muratori
(1672-1750) affermava infatti che nell'Italia medievale non c'era praticamente
città che non avesse un luogo destinato ai lebbrosi. Ma purtroppo, purtroppo
per Muratori e soprattutto per la nostra ricerca, il Medio Evo ha una durata
eccessiva. Oggi i limiti cronologici più comunemente ammessi vanno dalla
deposizione dell'ultimo imperatore romano d'Occidente (476, Romolo Augustolo![]() )
alla scoperta dell'America (1492), quindi 1016 anni. Ma addirittura più lungo
parrebbe il Medio Evo di Muratori qualora avesse adottato (e credo l'abbia
adottato) ciò che per la prima volta fu stabilito dal suo predecessore
tedesco Cristoforo Keller (Cellarius, 1638-1707) nella sua Historia
medii aevi. Per Keller il Medio Evo si estendeva dai tempi di Costantino
(280-337) alla caduta di Costantinopoli del 1453, quindi, partendo dalla morte
di Costantino, di 100 anni più lungo del nostro (1116 contro 1016).
)
alla scoperta dell'America (1492), quindi 1016 anni. Ma addirittura più lungo
parrebbe il Medio Evo di Muratori qualora avesse adottato (e credo l'abbia
adottato) ciò che per la prima volta fu stabilito dal suo predecessore
tedesco Cristoforo Keller (Cellarius, 1638-1707) nella sua Historia
medii aevi. Per Keller il Medio Evo si estendeva dai tempi di Costantino
(280-337) alla caduta di Costantinopoli del 1453, quindi, partendo dalla morte
di Costantino, di 100 anni più lungo del nostro (1116 contro 1016).
Per non parlare della durata del Medio Evo dell'urbinate Francesco Puccinotti (1794-1872), professore di Storia della Medicina presso l'Università di Pisa, il quale in Storia della Medicina (vol. II, Medicina del Medio Evo, 1855) afferma che dal punto di vista medico il Medio Evo comprende ben più di 12 secoli: "Chiudevasi con Galeno [129/130-199/201] la medicina antica, ed ora siamo per entrare in quella del Medio Evo. La quale per noi comprende oltre a dodici Secoli, cioè dal terzo dell'era cristiana sino alla metà del secolo decimosesto, poco oltre alla quale nacque il Galileo [1564-1642], e da lui facciamo incominciare la storia della medicina moderna." Quindi 1350 anni, e ciò per puri motivi di fasi in cui bisogna suddividere la scienza medica, in quanto per motivi storici o politici o artistici i limiti possono essere ovviamente diversi nonché inferiori.
Tenuto conto dell'isola veneziana intitolata a San
Lazzaro nel 1182, non voglio convincervi che il primo caso di lebbra italiana
si ebbe a Bologna nel 1014, ammesso ma assolutamente non concesso che fosse
dovuta al Mycobacterium leprae. Tuttavia Cesare Cantù (1804-1895) in Storia
degli Italiani (IV, 1857) aggiunge un altro elemento a questa ipotesi
prioritaria del 1014, affermando che una precisa descrizione della lebbra vera
risale al 1087 e che la dobbiamo a Costantino Africano![]() della Scuola Salernitana, morto a Cassino proprio
nel 1087, quindi 73 anni dopo l'evento bolognese.
della Scuola Salernitana, morto a Cassino proprio
nel 1087, quindi 73 anni dopo l'evento bolognese.

Cesare Cantù - Storia degli Italiani IV 1857
Costantino ne parla nel De morborum cognitione et
curatione (1536 - VII,17 De
elephantiasi![]() )
ed effettivamente possiamo associarci a Cantù nell'affermare che ne disquisì
a ragion veduta, ma è del tutto aleatorio per noi medici del XXI secolo –
che ci troveremmo in gramaglie nel diagnosticare un morbo di Hansen, come
pretende l'attuale eufemismo, che oltretutto etichetta gli impotenti come
Tirolesi – è del tutto aleatorio, si diceva, per noi medici del XXI secolo
affermare che la descrizione e la suddivisione della lebbra in 4 tipi (quadrifaria)
proposta da Costantino, sotto il termine allora corrente di elefantiasi,
corrisponda alla clinica della lebbra da Mycobacterium leprae anziché
ad altre patologie. In un'affermazione Costantino pare masticare piuttosto
bene la materia, quando nella sezione terapeutica afferma che la lebbra è
difficile da curare perché, quando viene diagnosticata, ha invaso l'organismo
già da troppo tempo - Lepra difficilis est ad curandum, et hoc ideo quia cum
cognoscitur, diu est quod corpus invasit.
)
ed effettivamente possiamo associarci a Cantù nell'affermare che ne disquisì
a ragion veduta, ma è del tutto aleatorio per noi medici del XXI secolo –
che ci troveremmo in gramaglie nel diagnosticare un morbo di Hansen, come
pretende l'attuale eufemismo, che oltretutto etichetta gli impotenti come
Tirolesi – è del tutto aleatorio, si diceva, per noi medici del XXI secolo
affermare che la descrizione e la suddivisione della lebbra in 4 tipi (quadrifaria)
proposta da Costantino, sotto il termine allora corrente di elefantiasi,
corrisponda alla clinica della lebbra da Mycobacterium leprae anziché
ad altre patologie. In un'affermazione Costantino pare masticare piuttosto
bene la materia, quando nella sezione terapeutica afferma che la lebbra è
difficile da curare perché, quando viene diagnosticata, ha invaso l'organismo
già da troppo tempo - Lepra difficilis est ad curandum, et hoc ideo quia cum
cognoscitur, diu est quod corpus invasit.
Chiederemo
lumi a San Pietro
per sapere la verità circa la lebbra bolognese del 1014
Costantino
Africano
De morborum cognitione et
curatione
1536 - VII,17



Il nome Lazzaro ha all’origine l’ebraico Eleazaro e significa “colui che è assistito da Dio”. Il Lazzaro di cui parliamo è il personaggio della parabola raccontata da Gesù del ricco epulone e del povero mendicante lebbroso.
Questa parabola riportata solo nel Vangelo di San Luca (16, 19-31) è l’unica in cui un personaggio di fantasia abbia un nome: Lazzaro. Ma come è avvenuto per vari personaggi minori, che compaiono nei racconti evangelici e che in seguito nella tradizione cristiana hanno ricevuto un culto, un ricordo perenne, un titolo di santo, anche per Lazzaro, pur essendo un personaggio protagonista di un racconto di fantasia (da non confondere con Lazzaro di Betania resuscitato da Gesù), nel corso del tempo si è instaurata una devozione, come se fosse stato un personaggio realmente esistito.
È chiaro che la parabola di Gesù contiene in sé un insegnamento universale e molto sentito, specie in quei tempi. Essa è raccontata per mostrare, ai farisei e a tutti gli avari, dove portano le ricchezze usate per soddisfare il proprio egoismo.
“Vi era un uomo ricco che vestiva di porpora e di bisso e ogni giorno faceva
splendidi banchetti. Un mendicante di nome Lazzaro, giaceva alla sua porta,
coperto di piaghe, bramoso di sfamarsi di quello che cadeva dalla mensa del
ricco e nessuno gliene dava; perfino i cani venivano a leccargli le piaghe.
Ora avvenne che il povero Lazzaro morì e fu portato dagli angeli nel seno di
Abramo.
Morì anche il ricco epulone e fu sepolto. Stando nell’inferno tra i
tormenti, levò gli occhi e vide lontano Abramo e Lazzaro accanto a lui.
Allora gridando disse: “Padre Abramo abbi pietà di me e manda Lazzaro a
intingere nell’acqua la punta del suo dito e bagnarmi la lingua, perché
questa fiamma mi tortura”.
Ma Abramo rispose: “Figlio ricordati che hai ricevuto i tuoi beni durante la
vita e Lazzaro parimenti i suoi mali; ora invece lui è consolato, mentre tu
sei tormentato e per di più fra noi e voi è stato fissato per sempre un
grande abisso, di modo che quelli che volessero di qui passare e venire a voi
non possono, né da lì si può attraversare fino a noi”.
Allora egli soggiunse: “Ti prego dunque, o padre, di mandarlo a casa del
padre mio, perché ho cinque fratelli; li ammonisca perché non vengano
anch’essi in questo luogo di tormento”.
Ma Abramo rispose: “Hanno Mosè e i Profeti, ascoltino loro”, ma egli
insisté: “No, padre Abramo, se però qualcuno dei morti andrà da loro, si
ravvederanno”. Abramo rispose: “Se non ascoltano Mosè e i Profeti, non
crederanno neppure se uno risuscitasse dai morti”.
La celebre parabola, riportata solo da Luca del ricco epulone e del misero Lazzaro, è un’antitesi che da sociale diventa anche religiosa, esaltando la povertà come modello di protezione divina. In essa si considera la figura di Lazzaro, che nel suo umiliante e penoso stato di mendicante e ammalato ha pazienza, anche davanti allo sprezzante trattamento che riceve dal ricco gaudente, pensando al Paradiso (seno di Abramo) che Gesù ha promesso ai poveri di spirito.
Perciò il Signore, che vede l’animo, appena morto lo fa trasportare in trionfo dagli angeli nella beatitudine eterna. Ora questo rivela come egli sopportava il suo stato, con rassegnazione unita alla speranza del Paradiso, fiducioso in Dio, Padre di tutti, che premia i buoni, anche se poveri e mendicanti.
San Giovanni Crisostomo![]() , parlando di Lazzaro esclama: “Chiunque voi siate,
o ricchi o poveri, l’avete visto disprezzato nel vestibolo dell’epulone,
miratelo ora radiante nel seno di Abramo; l’avete visto quando giaceva
attorniato da cani che gli leccavano le piaghe, contemplatelo ora circondato
da angeli; l’avete visto nella fame, contemplatelo nell’abbondanza di ogni
bene, l’avete visto nella lotta, osservatelo vincitore incoronato, avete
visto i suoi travagli, miratene il premio.”
, parlando di Lazzaro esclama: “Chiunque voi siate,
o ricchi o poveri, l’avete visto disprezzato nel vestibolo dell’epulone,
miratelo ora radiante nel seno di Abramo; l’avete visto quando giaceva
attorniato da cani che gli leccavano le piaghe, contemplatelo ora circondato
da angeli; l’avete visto nella fame, contemplatelo nell’abbondanza di ogni
bene, l’avete visto nella lotta, osservatelo vincitore incoronato, avete
visto i suoi travagli, miratene il premio.”
La parabola ci dà lo spunto per tante altre riflessioni che non possiamo qui, per motivi di spazio, approfondire: la sepoltura splendida del ricco, similitudine del seno di Abramo con il Paradiso cristiano, l’esistenza del tormento infernale, l’impossibilità di passare dai morti ai vivi, dalle anime elette alle anime in tormento, private perciò della visione e della beatitudine di Dio, l’incitamento a seguire gli insegnamenti provenienti da persone incaricate da Dio, di trasmettere le Sue volontà e leggi, senza aspettare prove straordinarie per credere.
La figura di Lazzaro e la scena del banchetto ha sempre ispirato la fantasia degli artisti, che in tutti i secoli lo hanno raffigurato, contribuendo così a innalzarlo a un simbolo della povertà e della sofferenza, premiate da Dio, quando accettate con rassegnazione e speranza nella Sua Divina Misericordia.
Per questo Lazzaro venne considerato come un santo, anche se la sua figura era in realtà fantasiosa ma simbolica. Il moderno Martirologio Romano non ne fa più menzione.
Egli è stato considerato il patrono dei lebbrosi quando la lebbra era una malattia molto più diffusa di oggi in tante parti del mondo. Dal suo nome scaturì la denominazione del lazzaretto, sorta di ricovero e cura per i lebbrosi o malati infettivi da tenere in isolamento. Infatti il primo di questi lazzaretti sorse a Venezia nell’isola di San Lazzaro.
Il nome Lazzaro è oggi poco usato e comunque chi lo porta si riferisce certamente ad altro San. Lazzaro (Lazzaro di Betania, oppure il martire principe serbo Lazzaro). In Spagna poi Lazzaro ha finito per assumere un significato peggiorativo come ‘pezzente’, da cui derivò a Napoli il termine ‘lazzarone’ introdotto al tempo dell’occupazione spagnola e di Masaniello, sempre indicante uno straccione, popolano, mascalzone, pezzente.
www.sancarloborromeo.org
Campo San Trovaso è un campo di Venezia situato nel sestiere di Dorsoduro. È considerato un luogo pittoresco e unico anche per la vicinanza a uno dei pochissimi cantieri di gondole della città, senz'altro il più noto e accessibile ai turisti: lo squero di San Trovaso.
Anche la sua struttura è insolita, dato che da una parte si sviluppa su due livelli e dall'altra presenta una piccola zona verde. A cavallo delle due parti sorge la maestosa chiesa di San Trovaso. Il suo strano nome (non esiste un santo di nome Trovaso) è nato dalla fusione di quello di due santi, San Gervasio e San Protasio, alla cui accoppiata è dedicato un campiello nelle vicinanze.
Santi Gervasio e Protasio
Martiri e santi, patroni di Milano, forse del sec. III. La Passio del sec. VI che li dice gemelli e figli dei SS. Vitale e Valeria è falsa e diede luogo a una letteratura devozionale parimenti leggendaria. La loro devozione, molto sentita a Milano, si diffuse anche alle Gallie, alla Spagna e all'Africa del Nord. Le loro reliquie furono ritrovate nel 386 nella Basilica Vetus; a essi venne allora dedicata la basilica ambrosiana.
Dorsoduro
Dorsoduro è uno dei sestieri di Venezia. Il 12 dicembre 2007 contava 15.586 abitanti (di cui 4.763 alla Giudecca e 1.535 a Sacca Fisola). Il nome deriverebbe dal fatto che la zona era un tempo caratterizzata da un terreno stabile (dal dorso duro), meno paludoso che altrove.
Viene delimitato a nord dai sestieri di Santa Croce e San Polo, dal Rio Ca' Foscari e dal Rio Malcanton; a est dal Canal Grande; a sud comprende il canale della Giudecca e l'omonima isola. È collegato al sestiere di San Marco tramite il ponte dell'Accademia.
La parte occidentale del sestiere è costituita dall'isola Mendigola, che fu tra le primissime zone della città a essere colonizzata, alcuni secoli prima che Rialto divenisse il centro vitale di Venezia (810). Dove sorgeva quest'isola venne poi costruita l'importante chiesa di San Nicolò dei Mendicoli risalente all'XI secolo. Le isole vicine vennero colonizzate in seguito, fino a raggiungere la Punta della Dogana, che prende il nome dal fatto che qui si ergeva la Dogana di Venezia.
L'ultima area bonificata fu la zona che si estende fra la Dogana da Mar e il monastero (in pratica, dove oggi sorge la basilica di Santa Maria della Salute). Al di là del Canal Grande si può notare Piazza San Marco ma l'unico modo per raggiungerla è attraversare il ponte dell'Accademia. Dopo San Marco, Dorsoduro è il sestiere di Venezia dove più si concentrano musei importanti. Il museo principale è la Galleria dell'Accademia, istituita dal pittore Giambattista Piazzetta nel 1750, e trasferita in questi edifici da Napoleone nel 1807.
Di grande rilievo anche la Collezione Peggy Guggenheim di arte moderna e contemporanea, a Palazzo Venier dei Leoni un tempo anche residenza privata della mecenate americana. Qui sorgono anche Ca' Rezzonico, con il museo del Settecento veneziano, Ca' Dario, tristemente nota per la fine tragica dei suoi ultimi proprietari, e la Scuola Grande dei Carmini. Le chiese più importanti sono la basilica di Santa Maria della Salute, la chiesa di Santa Maria del Rosario detta I Gesuati e la chiesa di San Nicolò dei Mendicoli. Meritano una visita anche lo squero di San Trovaso e campo Santa Margherita, luogo di ritrovo per veneziani e studenti.
Squero di San Trovaso

Lo Squero di San Trovaso è uno dei più antichi e famosi squeri veneziani. Lo squero (ossia cantiere in veneziano, dalla parola "squara" che indica l'attrezzo adoperato per costruire le imbarcazioni) è il classico cantiere dove si costruivano e riparavano le imbarcazioni di dimensioni contenute come gondole, pupparini, sandoli, sciopòni e altri natanti tipici della tradizione navale veneziana.
Quello di San Trovaso sorge lungo il rio omonimo e risale al Seicento. È uno dei pochissimi squeri ancora in funzione a Venezia, anche se oggi vi vengono prodotte o riparate soltanto gondole, mentre in passato l'attività cantieristica si estendeva anche ad altri tipi di barche. L'edificio che lo ospita ha la forma tipica delle case di montagna, circostanza eccezionale per Venezia. Il motivo è duplice: da una parte tanto i carpentieri quanto il legname da costruzione provenivano dal Cadore, dall'altra l'inclinazione del piazzale antistante e la tettoia che in parte lo ricopre erano utili in caso di pioggia, oltre che come deposito per gli strumenti di lavoro.

Di fronte al Lido è situata l'isola del Lazzaretto Vecchio, la quale inizialmente venne abitata dagli Eremitani che costruirono la chiesetta di Santa Maria di Nazareth, da cui derivò il nome originario di Nazarethum, trasformatosi col tempo in quello che oggi è comunemente detto "Lazzaretto".
http://digilander.libero.it/venexian
San Lazzaro degli Armeni
San Lazzaro degli Armeni - prima detta San Lazzaro o Lazzaretto Vecchio per distinguerla
dal Lazzaretto Nuovo, istituito in un'altra isola di Venezia nel 1468 - è una piccola isola nella laguna veneziana e si
trova immediatamente a ovest del Lido, completamente occupata da un monastero
che è la casa madre dell'ordine dei Mekhitaristi![]() . L'isola è uno dei primi
centri del mondo di cultura armena.
. L'isola è uno dei primi
centri del mondo di cultura armena.
L'isolotto, a una certa distanza dalle isole principali che formano il centro storico di Venezia, era nella posizione ideale per lo stazionamento in quarantena e fu perciò usato dal dodicesimo secolo come lebbrosario (lazzaretto), ricevendo il relativo nome da San Lazzaro mendicante, patrono dei lebbrosi.

Abbandonato nel sedicesimo secolo, nel 1717 fu dato dalla Repubblica di Venezia a un gruppo di monaci armeni che erano fuggiti dalla persecuzione turca a Istanbul, cinque anni dopo fu disposto sotto la protezione del Papa. Mekhitar e i suoi diciassette monaci restaurarono la chiesa e ivi costruirono un monastero, ingrandirono di quattro volte l'isola fino all'attuale grandezza di 3 ettari.
La Chiesa di San Lazzaro degli Armeni ospita una biblioteca di circa 200.000 volumi, così come un museo con oltre 4.000 manoscritti armeni e molti manufatti arabi, indiani ed egiziani, tra cui la curiosa mummia di Nemenkhet del VII sec. aC contenuta in un sarcofago del 3000 aC (come mi ha precisato Padre Vertanes in un colloquio telefonico del 6 agosto 2008), raccolti dai monaci o ricevuti come regali. Il monastero e i relativi giardini possono essere raggiunti dal vaporetto numero 20 da San Zaccaria. Al momento in cui scriviamo (estate 2008) c'è una sola visita guidata al giorno, che si svolge alle ore 15:00, in coincidenza con l'arrivo del vaporetto che lascia San Zaccaria alle 14:45.
Gruppi consistenti di visitatori possono chiedere un giro riservato a orari diversi. La messa si celebra ogni domenica con rito cattolico armeno alle ore 11.00. Padre Vertanes e altri padri conducono le visite in varie lingue. L'isola ha inoltre una lunga tradizione di ospitalità agli eruditi e agli allievi dell'Armenia, fra i quali anche Lord Byron, che ha studiato l'armeno lì nel 1816 e che si ricorda in una mostra permanente. Pare che il poeta amasse molto la speciale Vartanush, marmellata di petali di rosa che i monaci producono tuttora grazie ai rosai coltivati nell'isola, alcuni dei quali molto rari.

L'isola di San Lazzaro
prima dell'arrivo di Mekhitar

Nell'810 la Serenissima affida l'isola all'Abate del Monastero benedettino di Sant'Ilario di Fusina. Nei secoli successivi verrà adibita dal Senato a ospedale per pellegrini, "lazzaretto", nonché ricovero per i poveri.
Nel 1182 il nobile Leone Paolini ottiene il permesso di trasferire l'ospedale dei lebbrosi da San Trovaso nell'isola, che riceve in dono dall'Abate Uberto. Da allora in poi verrà denominata Isola di San Lazzaro, al pari dei lazzaretti dei lebbrosi sparsi in Italia. All'epoca viene pure costruita una prima chiesa, forse dedicata a San Leone Magno.
Nel 1348 il lebbrosario è oggetto di restauri mentre l'isola passa alla cattedrale patriarcale di San Pietro. Viene costruita l'attuale chiesa e dedicata a San Lazzaro, come documentato dall'iscrizione dell'architrave dell'antico ingresso, ora nell'atrio del monastero.
Verso la metà del '500, ridotti i lebbrosi a pochissimi individui, il Senato decide di ospitare in San Lazzaro i poveri della città e procede ad alcuni restauri. Ma a causa della lontananza, l'ospizio viene trasferito a San Giovanni e Paolo: nel 1601 tutte le suppellettili, gli arredi sacri e le reliquie dei santi vengono trasferite nella nuova sede e l'isola viene abbandonata.
Nel 1651 alcuni religiosi domenicani profughi da Creta, prendono dimora in San Lazzaro, ottenendola in affitto dalla confraternita dei Mendicanti, e la abbandonano dopo 20 anni.
Nel 1678 l'isola è data in concessione ai Gesuiti, che la abbandonano poco dopo. Successivamente è in mano a un tal Cristoforo Freschi, che deve cedere all'ordinanza del Senato che la trasforma temporaneamente in una fabbrica di armamenti per sovvenire alle necessità della guerra nella Morea veneziana.
Nel 1696 San Lazzaro è menzionata dal Coronelli come abitata da un Cappellano che vi officia una Messa quotidiana, con responsabilità di custodia, e da alcuni ortolani. "Il circuito di quest'isola è tenuto recinto di muro, e se non fosse per l'incomodo delle secche, e paludi, che la circondano, riuscirebbe assai delitiosa." (Vincenzo Coronelli, Isolario, 1696)
Nel 1711 alcuni nobili, quali Paolo Pisani e Gian Francesco Labia, hanno il progetto di istituirvi un nosocomio, e ottengono dai Mendicanti l'autorizzazione; però il disegno non va in porto e l'isola rimane a uso degli ortolani.
www.mekhitar.org
Saint Lazarus Island

San Lazzaro degli Armeni is a small island in the Venetian Lagoon, lying immediately west of the Lido; completely occupied by a monastery that is the mother-house of the Mekhitarist Order, the island is one of the world's foremost centers of Armenian culture.
The islet's isolation, at some distance from the principal islands forming the actual city of Venice, made it an ideal location for the quarantine station and leper colony founded there in the twelfth century, receiving its name from St. Lazarus, patron saint of lepers. Abandoned in the sixteenth century, in 1717 it was given by the ruling council of Venice to a group of Armenian monks that had escaped from Turkish persecution, five years earlier placed themselves under the protection of the Pope, and eventually made their way to Venice. Mekhitar and his seventeen monks built a monastery, restored the old church, and enlarged the island to its present 30,000 square metres, about four times its original area.
Its founder's temperament and natural gifts for scholarly pursuits immediately set the Mekhitarist Order in the forefront of Oriental studies: the monastery published Armenian historical, philological and literary works and related material, renowned for their scholarship and accuracy as well as for the beauty of the editions, on its own multilingual presses, which shut down in 1991, although an eighteenth century printing press may still be seen. S. Lazzaro houses a 150,000-volume library, as well as a museum with over 4,000 Armenian manuscripts and many Arab, Indian and Egyptian artifacts collected by the monks or received as gifts.
The monastery and its gardens, noted for its peacocks, may be reached by vaporetto (#20 from S. Zaccaria, near Piazza San Marco). In the Summer of 2008 there is one guided tour a day, starting at 15.00, on arrival of the vaporetto that leaves S. Zaccaria at 14.45. Groups of visitors may ask a private tour with different schedule. Father Vertanes and other fathers guide the tours in several different languages. It also has a long tradition of hospitality to scholars and students, among whom Lord Byron, who studied Armenian there during much of the year 1816, is remembered by a permanent exhibition.
Île Saint Lazare

San Lazzaro degli Armeni (Saint Lazare des Arméniens) est une île de la lagune de Venise. Elle est à une centaine de mètres à l'ouest de l'île du Lido. Elle est entièrement occupée par un monastère, siège de le congrégation des pères mékhitaristes.
Au XIIe siècle, des moines occupent l'île et y bâtissent une léproserie, une des premières au monde. En 1717, l'île alors abandonnée depuis le XVIe siècle, fut offerte par la sérenissime république à un moine arménien, le père Mékhitar, fuyant la persécution turque à Istambul. Aidé de plusieurs moines, Mékhitar restaure l'église du XIIe siècle et, autour, y fonde un monastère. En 1805, Napoléon Bonaparte incorpore Venise à son nouveau royaume italien. Prenant connaissance du travail scientifique et littéraire pratiqué au sein du monastère, il décide de lui laisser une totale indépendance. Le manuscrit signé par l'empereur est aujourd'hui gardé au monastère.
Depuis cette époque, l'île a été plusieurs fois agrandie et atteint aujourd'hui quatre fois sa taille initiale et fait trois hectares. L'île est située dans la lagune de Venise, à 3 kilomètres au sud-est de la place Saint-Marc et à 200 mètres à l'ouest de l'île du Lido. L'unique moyen d'accès à l'île est le bateau et notamment la ligne numéro 20 du vaporetto qui relie la place Saint-Marc à San Servolo puis Saint-Lazarre.
Le monastère est aujourd'hui habité en permanence par une dizaine de personnes (curés, gardien et jardinier). Contrairement à la plupart des monastères catholiques, les curés mékhitaristes ne vouent pas leur existence au travail agricole ou manuel, mais au travail intellectuel et scientifique. Le musée du monastère propose des milliers d'œuvres dont des statues, des armes anciennes, des tableaux et de écrits. La momie égyptienne de Nemenkhet datant de 700 av. J.-C. et son sarcophage sont le clou de l'exposition.
La bibliothèque abrite 200 000 volumes dont certaines des toutes premières bibles, les premières bandes dessinées et livres de poche, ainsi que d'anciens manuscrits arabes, indiens ou égyptiens. Certains de ces manuscrits ont été prêtés au musée du Louvre en février 2006 pour l'exposition Armenia Sacra dans le cadre de l'année de l'Arménie en France.
En plus de la messe dominicale, des visites guidées sont organisées quotidiennement à 15h30 en plusieurs langues: italien, français, anglais, arménien, allemand...
Congregazione
Armena
Mechitarista

Mekhitar - il Consolatore - al secolo Pietro Manuk - nel 1744
Il
fondatore ed eponimo dell’ordine, Mekhitar, nasce a Sebaste, attuale Sivas,
nella Piccola Armenia, nel 1676. All’età di quindici anni entra nel convento
di Surb Nsan, letteralmente Santo Segno, retto da monaci armeni di Sant'Antonio
Abate![]() .
.
Sivas - Città con 219.000 abitanti della Turchia, capoluogo della provincia omonima, 360 km a est di Ankara, a 1275 m sull'alto corso del fiume Kizilirmak. Situata sulla ferrovia che collega Ankara a Kumairi (Armenia), è un importante centro commerciale, sede di industrie alimentari, tessili, meccaniche e dei materiali da costruzione. Nota in età classica come Sebaste, divenne in età bizantina capoluogo dell'Armenia Seconda. Intorno al 1000 l'imperatore Basilio II la barattò in cambio di altre terre col re d'Armenia Sembat III. Conquistata dai Selgiuchidi (1071), fu presa nel sec. XV dai Mongoli di Timur.
L’attività monacale di quel periodo in Armenia è molto ripiegata sul passato e il giovane Mekhitar mal sopporta questa situazione. La sua irrequietezza lo porta a frequenti spostamenti da Sebaste a Erzerum e poi a Etchmiadzin. Nel 1691 l’incontro con la cristianità occidentale attraverso un missionario gesuita, forse Jacques Villote, che impressiona molto il giovane. La chiesa armena è divisa da Roma in quanto formalmente monofisita, sebbene questa divisione è più dettata da motivi storici che da una reale divisione su temi teologici. Questa divisione è mal sopportata da Mekhitar che per tutta la sua vita cerca con tutti i mezzi di favorire il rientro nella chiesa cattolica dei credenti armeni.
Nel 1696 parte per Roma dove intende approfondire i suo studi, ma una grave malattia lo fa rientrare in patria. Quello stesso anno viene ordinato sacerdote e per quattro anni lavora al servizio della chiesa locale. Nel 1700 va a Costantinopoli e con una decina di discepoli inizia una vita comunitaria orientata alla predicazione e alla pubblicazione di scritti.
L’8 settembre 1701 festa della Natività di Maria la comunità si consacra al Signore con la protezione della Vergine. A causa della loro scelta entrano in conflitto con la chiesa originaria, come cristiani sono mal visti dalla maggioranza mussulmana e sono costretti a spostarsi a Modone nella penisola di Morea, a quel tempo sotto controllo della Serenissima. Nel 1705 la comunità presenta al papa Clemente XI la domanda d'approvazione dell’Ordine con queste parole:
« Lo scopo delle nostre Costituzioni è questo: anzitutto conservare la forma del monachesimo, che abbiamo preso dagli Armeni, così come la conservano i monaci armeni, non però senza i tre voti, che sono essenziali dello stato religioso. »
A questi tre voti (castità, povertà e obbedienza) Mekhitar volle aggiungervi un quarto: apostolato fino all’effusione del sangue. La sottolineatura dei voti è data dal fatto che nella tradizione del monachesimo armeno essi non venivano pronunciati esplicitamente. Questa non esplicita dichiarazione aveva portato a un minor rigore dell’applicazione degli stessi nella vita monacale armena del tempo. Con il nome di Congregazione riformata dei monaci armeni di Sant'Antonio abate essa viene accettata dalla chiesa cattolica ad experimentum nel 1711.
Un'altra caratteristica peculiare dell’ordine è l’obbligo, per i
suoi membri, di essere armeni almeno da parte di uno dei genitori. La
richiesta viene accolta come detto, ma Roma pretende l’adesione della
Congregazione a una regola accettata dalla Chiesa Cattolica, le opzioni sono
tra la regola di San Basilio![]() o di San Benedetto (la regola di Sant'Antonio Abate non aveva una base scritta) e
Mekhitar sceglie la regola di San
Benedetto che è più affine al suo modo di intendere il monachesimo.
o di San Benedetto (la regola di Sant'Antonio Abate non aveva una base scritta) e
Mekhitar sceglie la regola di San
Benedetto che è più affine al suo modo di intendere il monachesimo.
La permanenza dei Mekhitar nella penisola, gli permette di conoscere importanti uomini politici veneziani come: il futuro Doge, allora ammiraglio, Alvise Sebastiano Mocenigo e Angelo Emo che è governatore di Morea.
I venti di guerra che incombono sulla penisola fanno migrare l’Ordine a Venezia nel 1715. Temporaneamente vengono accolti presso la chiesa di San Martino, in attesa di una sistemazione definitiva che avverrà nel 1717 con l’assegnazione, da parte della serenissima, dell’isola di San Lazzaro dove vi ha la sua sede tuttora.
Mekhitar muore il 27 aprile del 1749, lasciando una solida realtà religiosa nelle mani del suo giovane successore Stephanos Melkonian, che la conduce fino al 1800. Seguendo l’esempio del fondatore, i monaci continuano il lavoro di riscoperta, di studio, di traduzione e di stampa di antichi scritti armeni e della traduzione in armeno di importanti opere sia classiche che della cristianità. Il lavoro di approfondimento e di studio di questa antica lingua ha permesso di riscoprire e far conoscere una ricca e importante letteratura.
La comunità, però, è scossa da tensioni che sfociano nel 1772 in una scissione. Un gruppo di monaci rimane a Venezia, mentre un altro abbandona San Lazzaro per dirigersi da prima a Trieste, dove vengono ben accolti dall’impero austriaco, in seguito si postano definitivamente a Vienna ove svolgono tuttora la loro attività.
I due rami mechitaristi svolgono attività simili, ma si può dire che il ramo viennese è meno attento alle posizioni teologiche-canoniche della Curia Romana rispetto a quello veneziano. L'Ordine, coerentemente con i suoi principi, ha dato un importantissimo contributo allo sviluppo culturale del popolo armeno. Nel 2000 i due rami si sono ricongiunti, riportando l'Ordine all'originaria unità.
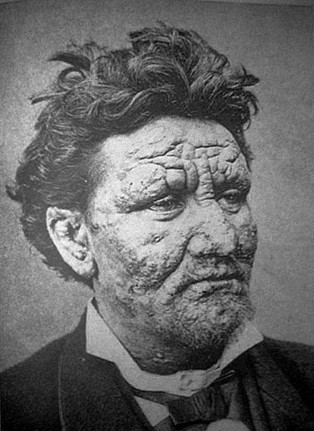
Uomo di 24 anni affetto da lebbra
La lebbra
o morbo di Hansen è una malattia infettiva e cronica, causata dal batterio Mycobacterium
leprae![]() , che colpisce la pelle e i nervi periferici in vari modi e gradi,
anche molto invalidanti. Un tempo considerata una maledizione di Dio e
incurabile, in era moderna si è rivelata molto meno temibile e meglio
curabile di quanto ritenuto in passato. Le dizioni "morbo di Hansen"
o "Hanseniasi" vengono oggi privilegiate per evitare il marchio di
infamia che la parola "lebbra" ancora reca con sé nell'opinione
comune.
, che colpisce la pelle e i nervi periferici in vari modi e gradi,
anche molto invalidanti. Un tempo considerata una maledizione di Dio e
incurabile, in era moderna si è rivelata molto meno temibile e meglio
curabile di quanto ritenuto in passato. Le dizioni "morbo di Hansen"
o "Hanseniasi" vengono oggi privilegiate per evitare il marchio di
infamia che la parola "lebbra" ancora reca con sé nell'opinione
comune.
Storia
La parola lebbra deriva dal greco leprós, scaglioso, scabro, aspro, dal verbo lépø = togliere la pelle o la scorza, sbucciare, pelare. Benché la lebbra sia generalmente considerata la malattia più antica del mondo, non si conosce con certezza l'epoca precisa della sua comparsa. Quasi certamente quella che nell'Antico Testamento, nel Levitico, è chiamata impropriamente lebbra (in ebraico Tzaraath) non è la stessa malattia che noi conosciamo. Si pensa che la malattia abbia avuto origine in India o in Africa.
Nelle leggi di Manu, nei Veda indiani (inizio del XV secolo aC), sono riportate istruzioni per la prevenzione della lebbra. Intorno al 400 aC la lebbra fece la sua comparsa in Cina: Da Feng nel "Nei Jing" intorno al 190 aC segnalava le tipiche lesioni cutanee anestesiche della lebbra.
Negli scritti di Ippocrate![]() (IV secolo aC) non c'è menzione di quadri
clinici riconducibili alla lebbra; la malattia probabilmente è stata portata
in Europa dai soldati di Alessandro il Grande
(IV secolo aC) non c'è menzione di quadri
clinici riconducibili alla lebbra; la malattia probabilmente è stata portata
in Europa dai soldati di Alessandro il Grande![]() di ritorno dall'India (326
aC). Il reperto più remoto di resti umani con segni indubbi di lebbra risale
al VI secolo (due mummie copte dell'Alto Egitto). La prima descrizione
completa di una malattia che corrisponda alla nostra nozione di lebbra viene
dall'India e risale al VII secolo dell'era cristiana.
di ritorno dall'India (326
aC). Il reperto più remoto di resti umani con segni indubbi di lebbra risale
al VI secolo (due mummie copte dell'Alto Egitto). La prima descrizione
completa di una malattia che corrisponda alla nostra nozione di lebbra viene
dall'India e risale al VII secolo dell'era cristiana.
Nel XIII secolo si ebbe la maggiore diffusione della lebbra in Europa, dove diventò endemica. Nel Medioevo i lebbrosi erano considerati impuri dalla Chiesa cattolica e dalla Società, pertanto erano costretti a vivere al di fuori delle città, nei lebbrosari. Il loro aspetto era tale da renderli oggetto di vere e proprie persecuzioni basate su improbabili accuse e che si concludevano in certi casi con imprigionamenti, reclusioni nelle loro abitazioni ma anche esecuzioni sul rogo. Emblematica la persecuzione francese del 1321 autorizzata direttamente dal Re Filippo V detto il Lungo con l'editto di Poitiers.

Cesare Cantù - Storia degli Italiani IV 1857
Nel 1953 Vilh Möller-Christensen trovò uno scheletro in un antico lebbrosario medievale in Danimarca che presentava alcune tipiche alterazioni della forma lepromatosa avanzata: la distruzione del processo alveolare della mascella e delle ossa nasali. L’endemia di lebbra in Europa si ridusse dal XV secolo.
Nel XVI secolo, venne esportata nell’America Latina, prima dai conquistatori spagnoli e portoghesi, poi dagli schiavi africani. Fino al XIX secolo si è creduto che la lebbra fosse una malattia ereditaria e dai più era considerata una punizione divina. Nel 1847 i dermatologi norvegesi Danielsen e Boeck offrirono la prima descrizione clinica lebbra tubercoloide. Nel 1852, in Messico, Rafael Lucio e Ignacio Alvarado descrissero clinicamente la lebbra lepromatosa diffusa, poi riconosciuta come forma lebbrosa da Fernando Latapì nel 1936.

Nel 1863 Rudolph Virchow (Schivelbein, Pomerania, 1821-Berlino 1902) descrisse per primo il reperto istopatologico della lebbra lepromatosa. Nel 1873 il medico norvegese Gerhard Hansen (Bergen 1841-1912) ne dimostrò l’eziologia batterica, evidenziando la presenza di bacilli in un nodulo cutaneo di un lebbroso. Il Mycobacterium leprae o bacillo di Hansen (BH) fu il primo batterio descritto come patogeno per l’uomo, una decina d’anni prima delle scoperte del medico tedesco Robert Koch (Clausthal, Hannover, 1843 - Baden-Baden 1910) relative al del bacillo della tubercolosi (1882).
Nel 1919 il medico giapponese Mitsuda descrisse l'intradermoreazione alla lepromina. Nel 1959 Piero Sensi, ricercatore della Lepetit, scoprì le rifamicine e da queste nel 1969 sviluppò la rifampicina, antibiotico attivo contro le micobatteriosi.
Eziologia
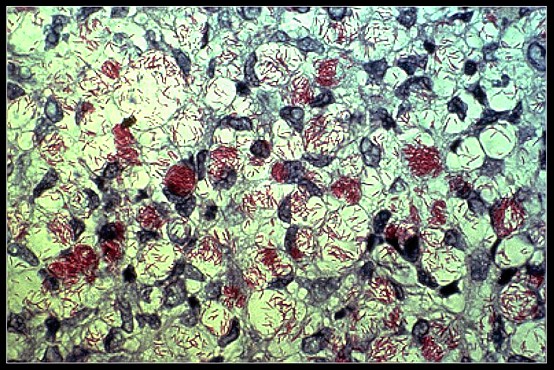
L'agente eziologico è il Mycobacterium leprae o bacillo di Hansen (BH), bacillo alcol-acido resistente (si colora con la metodica di Ziehl-Neelsen), molto simile al Mycobacterium tuberculosis o bacillo di Koch (BK), intracellulare obbligato, poco patogeno ma molto immunogeno. È difficile stabilirne la contagiosità perché è difficile diagnosticare i quadri asintomatici. Il BH si moltiplica molto lentamente e raddoppia in 18-42 giorni, molto meglio nelle parti più fredde del corpo (la pelle, le orecchie, le vie respiratorie superiori, la camera anteriore dell'occhio, i nervi periferici, i testicoli). Il BH non è in grado di crescere in terreni di coltura artificiali.
Epidemiologia
Diffusione della Lebbra nel mondo alla data del 2003
La stima del numero dei casi di lebbra attualmente nel mondo è difficile. Secondo l'OMS-WHO negli anni 1980 erano circa 12 milioni e negli anni 1990 sarebbero scesi drasticamente a 2,5 milioni circa. Nel 2000, l'OMS-WHO ha definito come aree di endemia per la lebbra 91 nazioni. Le maggiori prevalenze si hanno in India, Africa sub-Sahariana e Sud America. La lebbra è ancora presente nel Sud Est Asiatico, nelle Filippine, in Malaysia, nel Sud della Cina e nelle Isole del Pacifico. I pochissimi casi italiani sono quasi tutti di importazione. Circa 1/3 dei pazienti lebbrosi è inabile a causa degli esiti invalidanti della malattia. Sembra che gli individui più suscettibili alla lebbra siano i caucasici, seguiti da asiatici, indiani e africani. Nelle aree endemiche il 20%-30% dei casi di malattia sono pediatrici, ma anche se non trattati, non tutti cronicizzano. In Asia le forme lepromatose sommano il 50% dei casi e solo il 10% in Africa.
Modalità di trasmissione
L'esatto meccanismo di trasmissione del BH non è ancora del tutto chiaro. Il
bacillo è stato trovato in molte varietà di insetti ma non è mai stata
dimostrata la trasmissione vettoriale. Si è ipotizzata una trasmissione per
contatto cutaneo e per iniezione con aghi contaminati. Il bacillo viene
certamente trasmesso attraverso un contatto stretto e prolungato con pazienti
bacilliferi non trattati, che eliminano bacilli dalle mucose delle vie
respiratorie superiori. Già dopo la prima dose di rifampicina la carica
infettante viene ridotta del 99,99%, sicché i pazienti trattati non sono
contagiosi. Benché si possano trovare BH nel latte materno e nella placenta,
la lebbra colpisce raramente i bimbi piccoli. La specie di armadillo Dasypus
novemcinctus![]() può essere infettata dal BH ed è stato ipotizzato che ne
possa rappresentare un serbatoio naturale. In laboratorio si è ottenuta
l'infezione con BH di criceti, topi e anche scimmie, con manifestazioni
cliniche molto simili a quelle umane.
può essere infettata dal BH ed è stato ipotizzato che ne
possa rappresentare un serbatoio naturale. In laboratorio si è ottenuta
l'infezione con BH di criceti, topi e anche scimmie, con manifestazioni
cliniche molto simili a quelle umane.
Patogenesi
Dopo essere penetrati nel derma, i BH si moltiplicano all'interno delle cellule del sistema monocito-macrofagico: se i macrofagi riescono a distruggere i BH, l'infezione abortisce; se non riescono a contenere l'infezione la malattia evolve. I BH attaccano gli istiociti del derma e le cellule di Schwann dei nervi periferici. L'intensità della reazione cellulo-mediata dell'organismo determina la forma in cui la malattia si manifesta. Se essa è sufficiente ad arginare l'infezione, la malattia viene delimitata in una o poche lesioni nelle quali i BH sono rarissimi (forma tubercoloide); all'estremo opposto, se non c'è nessuna risposta immunitaria cellulo-mediata, i BH si disseminano a tutto l'organismo (forma lepromatosa).
Clinica
Il periodo di incubazione dura in media 5 anni, ma varia da pochi mesi fino a 10 anni. La lebbra presenta un ventaglio molto ampio di manifestazioni cliniche, spesso dai confini sfumati, comprese tra due poli estremi: la forma tubercoloide e la forma lepromatosa. La forma di lebbra che si sviluppa è condizionata dal tipo di risposta immunitaria cellulo-mediata montata dall'ospite. Da un punto di vista pratico terapeutico le forme sono distinte in paucibacillari e multibacillari.
La forma indeterminata è la forma più benigna: può evolvere verso uno dei due poli o restare stabile o guarire completamente. Si manifesta con la comparsa di una lesione cutanea maculare, non rilevata, a margini netti, ipocromica e/o eritematosa (rossa su pelle chiara, color del rame su pelle nera) e/o disestesica (comunque la sensibilità è ancora presente) e/o alopecica. La lesione potrebbe rappresentare il sito di entrata del BH. Di solito non si trovano bacilli alcol-acido resistenti (BAAR) in queste lesioni, pertanto è molto difficile da diagnosticare. La lesione cutanea è stabile e non risponde alla terapia locale. Il sospetto clinico viene confermato dal reperto istologico di un infiltrato infiammatorio focale nel derma e nel nervo periferico vicino.
Le forme paucibacillari presentano un massimo di 5 lesioni cutanee e/o un nervo periferico coinvolto.
La forma tubercoloide secondo Ridley viene ulteriormente distinta in tubercoloide polare (TT), tubercoloide secondaria (TTs) e tubercoloide dimorfa (DT), spostandosi verso il polo lepromatoso. Si manifesta con poche macule o placche (spesso una lesione unica) eritematose, a volte come lesioni papulose raggruppate; le lesioni sono infiltrate, sempre ben delimitate, a distribuzione asimmetrica monolaterale, con superficie anidrosica (secca e ruvida al tatto), alopecica, ipo-anestesica. I follicoli sebacei e le ghiandole sudoripare della porzione di cute colpita vengono distrutti. L'infiltrato cellulare si estende fino all'epidermide coinvolgendo lo strato basale. La reazione cellulare, insorta per contrastare l'infezione e la diffusione dei BH, porta alla formazione dei granulomi lepromatosi, composti dalle cellule giganti tipo Langhans e da cellule epiteliodi, circondate da piccoli linfociti. L'interessamento nervoso nelle forme tubercoloidi è "neuroclastico": il grande nervo periferico colpito appare edematoso e ispessito, con possibile danno da incarceramento nel perinervio; il danno neurologico è rapido con comparsa di anestesia (nervi sensitivi), amiotrofia e ipostenia (nervi motori), ulcere trofiche del territorio da essi innervato. Le prime strutture nervose coinvolte sono le piccole terminazioni distali cutanee. I grandi nervi periferici sensitivo-motori, vicini alla lesione cutanea, vengono coinvolti e danneggiati dalla reazione granulomatosa. I nervi più spesso colpiti sono, nell'arto superiore, l'ulnare, il mediano e il radiale, nell'arto inferiore, il fibulare e il tibiale. Dei nervi cranici sono colpiti il trigemino e il faciale. Nonostante tutto ciò, la bacilloscopia è negativa, o comunque i bacilli riscontrabili sono rari. L'intradermoreazione di Mitsuda è debolmente positiva, segno della presenza, comunque, di una risposta immunitaria cellulo-mediata, responsabile della formazione del granuloma.
Forme multibacillari. Presentano più di 5 lesioni cutanee e/o più di un nervo periferico coinvolto.
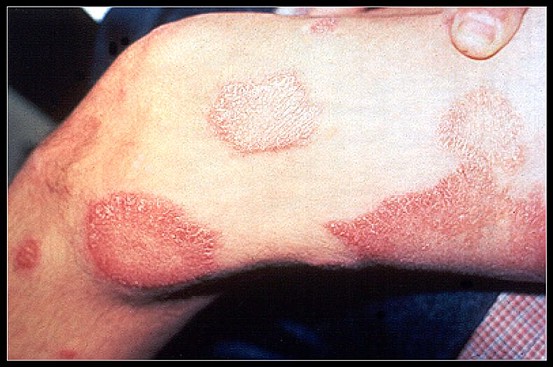
Placche cutanee eritematose (forma dimorfa)
Forma dimorfa (di confine). Secondo Ridley viene ulteriormente distinta in tubercoloide dimorfa (DT), dimorfa (DD) e lepromatosa (virchowiana) dimorfa (DV), spostandosi verso il polo lepromatoso. Si manifesta con macule, papule o placche eritematose roseo-violacee, polimorfe, di grandi dimensioni, uniformemente infiltrate con guarigione centrale, con bordi interni netti ed esterni sfumati (possono essere rilevati, per la presenza delle papule); le lesioni sono poche bilaterali asimmetriche in DT o molte e simmetriche in DV. La compromissione nervosa è meno grave di TT ma più estesa e simmetrica. La bacilloscopia è negativa o positiva con rari BH. Sono forme a rischio per i cosiddetti "stati reattivi lebbrosi".
Forma lepromatosa (virchowiana). Secondo Ridley viene ulteriormente distinta in lepromatosa dimorfa (DV), lepromatosa subpolare (VVs), lepromatosa polare (VV). La forma si sviluppa quando la reazione cellulo-mediata è scarsa o nulla, infatti spesso l'intradermoreazione di Mitsuda è negativa. La lebbra lepromatosa è una malattia sistemica, con coinvolgimento di molti organi. La lesione istologica è il "leproma", formato da numerosi istiociti impacchettati contenenti una grande quantità di BH. Non c'è l'infiltrato linfocitario tipico del granuloma lepromatoso, che, in questi casi, non si forma. I BH sono presenti in grandi quantità nelle cellule di Schwann e c'è edema del perinervio senza infiltrato cellulare. La malattia non viene contenuta dal granuloma lepromatoso e si dissemina rapidamente, sia per contiguità sia per via ematica, ad altre zone cutanee, nervi, alle mucose e a tutti gli organi: i BH prediligono localizzarsi agli occhi, ai testicoli, al midollo osseo, e in misura minore ai muscoli scheletrici, al fegato, ai linfonodi, alla milza. All’inizio compaiono macule ipocromiche a margini sfumati, spesso visualizzabili con luce con incidente diversa da quella dell'ispezione, poi le lesioni diventano infiltrate e possono comparire anche lesioni solide che si estendono a cute e mucose: papule, noduli, placche isolate o confluenti a distribuzione bilaterale simmetrica. I BH sono abbondanti nelle lesioni cutanee e vengono eliminati in grandi quantità dalle mucose nasali. Le lesioni al volto conferiscono la tipica "facies leonina", con madarosi (alopecia di ciglia e sopracciglia), ispessimento dei padiglioni auricolari: la cartilagine nasale è invasa e distrutta, il setto nasale si ulcera e lo scheletro nasale può collassare e si schiaccia. Lo scheletro viene attaccato direttamente e vengono interessati in modo particolare oltre alle ossa nasali, le dita di mani e piedi e il processo alveolare dell'osso mascellare. L'occhio viene colpito per via ematica: le lesioni lepromatose colpiscono la congiuntiva. Si hanno cheratiti e irido-cicliti. Il danno ai tubuli seminiferi dei testicoli può causare sterilità. Il danno alle cellule di Leydig del testicolo contribuisce alla frequente comparsa della ginecomastia. Il danno epatico e renale può essere importante. Il danno neurologico colpisce precocemente le terminazioni nervose più distali: all'inizio non c'è anestesia perché l'interessamento dei grandi tronchi nervosi è più lento e tardivo, ma è peggiore che nelle forme tubercoloidi perché molto esteso e simmetrico. La compromissione sensitiva trofica provoca la comparsa di ulcerazioni che si complicano con infezioni, necrosi, deformazioni e amputazioni delle estremità.
Lebbra diffusa primitiva. Una forma diffusa pura della lebbra lepromatosa, detta di Lucio-Alvarado, è caratterizzata dalla completa assenza di risposta cellulo-mediata, ed è molto comune in America Latina, soprattutto in Messico. Si ha una infiltrazione eritematosa diffusa uniforme generalizzata della cute (eritrodermia), senza lesioni solide o distinguibili, con madarosi e alopecia generale precoce e rapida. Viene detta "lepra bonita" di Latapì, perché il viso di chi ne è colpito appare d'aspetto "bello" rubicondo, a causa dell'eritrodermia uniforme.
Stati reattivi lebbrosi. La lebbra è una malattia con manifestazioni flogistiche molto attenuate o pressoché inapparenti. I quadri flogistici eclatanti sono un segnale d'allarme, di una reazione immunologica dell'ospite, che può avere conseguenze gravi se non riconosciuta e trattata prontamente: le reazioni sono di due tipi.
tipo I - Complicano le forme interpolari da TTs a VVs e sono clinicamente simili tra loro e, quando guariscono, desquamano. RR (reversal-"up grading"-reaction, reacção reversa)- È un segno di miglioramento dopo terapia conseguente al risveglio di una risposta immunitaria cellulomediata efficace che sposta la forma clinica della malattia verso il polo tubercoloide. Tutte o alcune lesioni pre-esistenti diventano eritematose ed edematose (tipo erisipela) e possono comparire nuove lesioni. Si hanno nevriti dolorosissime, con gravi sequele in assenza di trattamento antiinfiammatorio, tanto peggiori quanto più grave è la reazione. La nevrite può manifestarsi in modo insidioso, anche senza dolore. RD (down grading, degradação). È un peggioramento, con spostamento del quadro clinico verso il polo lepromatoso. Si verifica nei casi non trattati, resistenti alla terapia o che interrompono troppo presto il trattamento. Le lesioni cutanee peggiorano, aumentano di numero e di simmetria e i bordi diventano più sfumati. Le nevriti sono meno intense ma più diffuse.
tipo II - Interessano le forme multibacillari (DV, VVs, VV). Eritema nodoso lebbroso. Si manifesta durante la terapia, soprattutto mono-terapia (ormai inammissibile), ed è provocata da deposizione di immunocomplessi circolanti (IC) nei tessuti colpiti. In tutto il corpo compaiono noduli eritematosi dolenti, isolati o confluenti, associati a febbre, malessere, mialgia: quando il quadro clinico migliora compaiono nuove lesioni cutanee. Possono aversi molti attacchi successivi: in tal caso si parla di stato di “male reattivo” (mal de reacção). Si possono avere anche altre manifestazioni di malattia da IC: artralgie, iridocicliti, epididimiti. Fenomeno di Lucio. Nelle forme diffuse di Lucio-Alvarado, dopo 2-4 anni, può comparire il cosiddetto "fenomeno di Lucio", che è un eritema necrosante di tipo vasculitico, per interessamento dei piccoli vasi cutanei. All'inizio compaiono macule rosso-violacee indolori o che danno una sensazione di cociore. Le lesioni evolvono in vescicole o bolle di piccole dimensioni, che poi diventano crostose e si ulcerano e lasciano una cicatrice atrofica. Spesso la malattia è complicata da episodi settici anche fatali. In questi casi l'intradermoreazione di Mitsuda è positiva.
Diagnosi
La diagnosi della lebbra è clinica e istologica. L'OMS-WHO definisce un caso di lebbra come quello di un individuo che mostri almeno uno dei seguenti criteri diagnostici:
Presenza di una o più lesioni cutanee con alterazioni della sensibilità.
L'ispessimento di uno o più nervi periferici con alterazioni della sensibilità.
Il reperto di bacilloscopia positiva per bacillo di Hansen.
Non è ancora disponibile un sistema accettabile di diagnosi delle forme di lebbra subcliniche.
Esami bioumorali - Generalmente non sono utili alla diagnosi eziologica.
Esami microbiologici - Il BH non cresce sui terreni di coltura degli altri
micobatteri. Cresce se inoculato nei polpastrelli di topi o, meglio ancora,
dell'armadillo![]() .
.
Indice batteriologico - È un sistema di determinazione della carica batterica delle lesioni cutanee. Si esamina con microscopio a immersione in olio di cedro a 100x un campione di scarificato cutaneo dopo colorazione di Ziehl-Neelsen e si contano i BH presenti. Il risultato viene espresso su una scala logaritmica:
1+ almeno 1 bacillo per 100 campi (paucibacillare)
2+ almeno 1 bacillo per 10 campi (multibacillare)
3+ almeno 1 bacillo per campo
4+ almeno 10 bacilli per campo
5+ almeno 100 bacilli per campo
6+ almeno 1000 bacilli per campo
Test dell'istamina - Le forme tubercoloidi provocano la comparsa di macule ipopigmentate. In un individuo sano l'istamina provoca normalmente una reazione eritematosa: nella lebbra tubercoloide la risposta della pelle all'istamina è ritardata, diminuita o assente. Il test è difficile da valutare nei pazienti di pelle nera.
Test della pilocarpina - La sudorazione dipende dall'integrità delle terminazioni nervose del sistema parasimpatico. Se una lesione ipopigmentata è lebbrosa la pilocarpina provoca una sudorazione minore del normale.
Intradermoreazione di Mitsuda-Hayashi - È analoga all'intradermoreazione di Mantoux per la tubercolosi. La reazione indica la presenza di un'immunità di tipo cellulo-mediato nei confronti del BH. È un esame poco affidabile perché ha troppi falsi positivi: si possono avere reazioni positive in casi di tubercolosi, vaccinazione con bacillo di Calmétte e Guerin (BCG) o per precedenti intardermoreazioni di Mitsuda. Impiega la lepromina, formata da una sospensione di BH morti, provenienti da un nodulo lepromatoso di armadillo. Se ne inietta sotto il derma 0.1 ml. Una lettura precoce (di Fernandez) della reazione cutanea, si esegue dopo 48-72 ore. Una lettura tardiva (di Mitsuda) si esegue dopo 21-28 giorni. La reazione è positiva se si forma una lesione papulare o nodulare eritematosa, del diametro di 5mm. La reazione è debolmente positiva nelle forme di lebbra tubercoloide (TT e DT) e può essere utile per la formulazione di una prognosi. La reazione è negativa nelle forme dimorfe e lepromatose della lebbra. Nelle forme indeterminate la reazione rispecchia la futura evoluzione della lebbra: se è negativa esclude la diagnosi di lebbra o indica che sta evolvendo verso le forme multibacillari, ipoergiche. Una Mitsuda che, da negativa, diventa positiva, indica un miglioramento della risposta immunitaria all'infezione e un'evoluzione verso il polo tubercoloide, con prognosi migliore.
Terapia
Non è più eticamente accettabile la mono-terapia, ma va sempre impiegata un'associazione di almeno due farmaci. I pazienti sono seguiti in regime ambulatoriale, tranne che negli stati reattivi che vanno seguiti in regime di ricovero.
forme paucibacillari
Dapsone 100mg/die
Rifampicina 600mg 1 volta/mese
per un periodo di 6 mesi
forme multibacillari
Dapsone 100mg/die
Rifampicina 600mg 1volta/mese
Clofazimina 50mg/die con una dose supplementare mensile di 300mg
per un periodo di almeno 2 anni, a volte per tutta la vita
stati reattivi
Prednisone 40-60mg/die
Talidomide 100-300mg/die (l'uso nelle donne è proibito per i suoi effetti
collaterali teratogeni)
Prognosi
Le forme tubercoloidi possono guarire, ma i danni neurologici (anestesia e paralisi delle strutture innervate dai rami danneggiati) possono essere permanenti. Le forme dimorfe possono guarire ma con esiti neurologici molto più invalidanti (deformità estese). Le forme lepromatose guariscono più raramente e di solito peggiorano progressivamente con cecità, scadimento delle condizioni generali fino all'insufficienza renale cronica. La terapia ha migliorato di molto la prognosi di tutte le forme e se è abbastanza precoce, previene la comparsa delle deformità.
Profilassi
Vaccini - Il bacillo di Calmette e Guerin (BCG), impiegato per la vaccinazione anti-tubercolare, si è dimostrato ancora più efficace per la prevenzione della lebbra, soprattutto delle forme multibacillari.
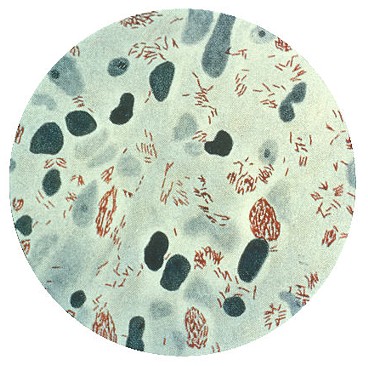
Il Mycobacterium leprae (conosciuto anche come Bacillo di Hansen), è l'agente eziologico della lebbra. Il bacillo fu scoperto dal dottorGerhard Henrik Armauer Hansen in Norvegia nel 1873. Ha forma bacillare e dimensioni comprese tra i 3-5 µm di lunghezza e 0,2-0,4 µm di diametro. Alcol-acido resistente (si colora con la metodica di Ziehl-Neelsen), molto simile al Mycobacterium tuberculosis o bacillo di Koch (BK), intracellulare obbligato, poco patogeno ma molto immunogeno. È difficile stabilirne la contagiosità perché è difficile diagnosticare i quadri asintomatici.
Il BH si moltiplica molto lentamente e raddoppia in 18-42 giorni, molto meglio nelle parti più fredde del corpo (la pelle, le orecchie, le vie respiratorie superiori, la camera anteriore dell'occhio, i nervi periferici, i testicoli). Il BH non è in grado di crescere in terreni di coltura artificiali. Fatica a crescere in coltura (in vitro) per le difficili esigenze nutritive, ma si sviluppa bene in vivo, soprattutto a temperature minori di 37°C come, nell'uomo, a carico del naso, delle orecchie, delle dita, ecc...
Le temperature caldo-umide favoriscono un habitat naturale per il bacillo; altre situazioni che ne favoriscono la crescita sono la denutrizione, la mancanza minima d'igiene e il sottosviluppo. Gli agenti di trasmissione sono soprattutto l'aria, il sangue e la saliva. In particolare bacillo tende a distruggere i nervi periferici causando insensibilità, che espone il contagiato a ferite e conseguente distruzione dei tessuti. Se la malattia non viene curata velocemente può provocare danni progressivi e permanenti a pelle, nervi, arti ed occhi. La forma tubercolare è il tipo di lebbra che provoca molto rapidamente le disabilità.

A 24-year-old man infected with leprosy
Leprosy, or Hansen's disease, is a chronic infectious disease caused by the bacterium Mycobacterium leprae. Leprosy is primarily a granulomatous disease of the peripheral nerves and mucosa of the upper respiratory tract; skin lesions are the primary external symptom. Left untreated, leprosy can be progressive, causing permanent damage to the skin, nerves, limbs, and eyes. Contrary to popular conception, leprosy does not cause body parts to simply fall off, and it differs from tzaraath, the malady described in the Hebrew scriptures and previously translated into English as leprosy.
Historically, leprosy has affected humanity since at least 600 BC, and was well-recognized in the civilizations of ancient China, Egypt and India. In 1995, the World Health Organization (WHO) estimated that between two and three million people were permanently disabled because of leprosy. Although the forced quarantine or segregation of patients is unnecessary — and can be considered unethical — a few leper colonies still remain around the world, in countries such as India, Japan, Egypt, and Vietnam.
The age-old social stigma associated with the advanced form of leprosy lingers in many areas, and remains a major obstacle to self-reporting and early treatment. Effective treatment for leprosy appeared in the late 1940s with the introduction of dapsone and its derivatives. However, leprosy bacilli resistant to dapsone gradually evolved and became widespread, and it was not until the introduction of multidrug therapy (MDT) in the early 1980s that the disease could be diagnosed and treated successfully within the community.
Characteristics

Cutaneous leprosy lesions on a patient's thigh
The clinical symptoms of leprosy vary but primarily affect the skin, nerves, and mucous membranes. Patients with this chronic infectious disease are classified as having paucibacillary Hansen's disease (tuberculoid leprosy), multibacillary Hansen's disease (lepromatous leprosy), or borderline leprosy.
Contrary to popular belief, Hansen's bacillus does not cause rotting of the flesh; rather, a long investigation by Paul Brand yielded that insensitivity in the limbs extremities was the reason why unfelt wounds or lesions, however minute, lead to undetected deterioration of the tissues, the lack of pain not triggering an immediate response as in a fully functioning body. Recently, leprosy has also emerged as a problem in HIV patients on antiretroviral drugs.
Classification
There is some confusion over classification because the WHO replaced an older, more complicated classification system with a simpler system that identifies two subtypes of leprosy - paucibacillary and multibacillary. The older system included six categories: Indeterminate Leprosy, Borderline Tuberculoid Leprosy, Midborderline Leprosy, Borderline Lepromatous Leprosy, Lepromatous Leprosy, and Tuberculoid Leprosy.
Paucibacillary leprosy encompasses indeterminate, tuberculoid, and borderline tuberculoid leprosy. It is characterized by one or more hypopigmented skin macules and anaesthetic patches, i.e., damaged peripheral nerves that have been attacked by the human host's immune cells.
Multibacillary leprosy includes midborderline, borderline lepromatous, and lepromatous leprosy. It is associated with symmetric skin lesions, nodules, plaques, thickened dermis, and frequent involvement of the nasal mucosa resulting in nasal congestion and epistaxis (nose bleeds) but typically detectable nerve damage is late.
Borderline leprosy is of intermediate severity and is the most common form. Skin lesions resemble tuberculoid leprosy but are more numerous and irregular; large patches may affect a whole limb, and peripheral nerve involvement with weakness and loss of sensation is common. This type is unstable and may become more like lepromatous leprosy or may undergo a reversal reaction, becoming more like the tuberculoid form.
Cause

Mycobacterium leprae, the causative agent of leprosy.
As acid-fast bacteria,
Mycobacterium leprae appear red
when a Ziehl-Neelsen stain is used.
Mycobacterium
leprae![]() is the causative agent of leprosy. An
intracellular, acid-fast bacterium, Mycobacterium leprae is aerobic,
gram-positive, and rod-shaped, and is surrounded by the waxy cell membrane
coating characteristic of Mycobacterium species.
is the causative agent of leprosy. An
intracellular, acid-fast bacterium, Mycobacterium leprae is aerobic,
gram-positive, and rod-shaped, and is surrounded by the waxy cell membrane
coating characteristic of Mycobacterium species.
Due to extensive loss of genes necessary for independent growth, M. leprae is unculturable in the laboratory, a factor which leads to difficulty in definitively identifying the organism under a strict interpretation of Koch's postulates. The use of non-culture-based techniques such as molecular genetics has allowed for alternative establishment of causation.
Pathophysiology
The exact mechanism of transmission of leprosy is not known: prolonged close
contact and transmission by nasal droplet have both been proposed, and, while
the latter fits the pattern of disease, both remain unproven. The only other
animals besides humans known to contract leprosy are the armadillo![]() , chimpanzee,
sooty mangabey, and cynomolgus macaque. The bacterium can also be grown in the
laboratory by injection into the footpads of mice. There is evidence that not
all people who are infected with M. leprae develop leprosy, and genetic
factors have long been thought to play a role, due to the observation of
clustering of leprosy around certain families, and the failure to understand
why certain individuals develop lepromatous leprosy while others develop other
types of leprosy. It is estimated that due to genetic factors, only 5 percent
of the population is susceptible to leprosy. This is mostly because the body
is naturally immune to the bacteria, and those persons who do become infected
are experiencing a severe allergic reaction to the disease. However, the role
of genetic factors is not entirely clear in determining this clinical
expression. In addition, malnutrition and prolonged exposure to infected
persons may play a role in development of the overt disease.
, chimpanzee,
sooty mangabey, and cynomolgus macaque. The bacterium can also be grown in the
laboratory by injection into the footpads of mice. There is evidence that not
all people who are infected with M. leprae develop leprosy, and genetic
factors have long been thought to play a role, due to the observation of
clustering of leprosy around certain families, and the failure to understand
why certain individuals develop lepromatous leprosy while others develop other
types of leprosy. It is estimated that due to genetic factors, only 5 percent
of the population is susceptible to leprosy. This is mostly because the body
is naturally immune to the bacteria, and those persons who do become infected
are experiencing a severe allergic reaction to the disease. However, the role
of genetic factors is not entirely clear in determining this clinical
expression. In addition, malnutrition and prolonged exposure to infected
persons may play a role in development of the overt disease.
The incubation period for the bacteria can last anywhere from two to ten years. The most widely held belief is that the disease is transmitted by contact between infected persons and healthy persons. In general, closeness of contact is related to the dose of infection, which in turn is related to the occurrence of disease. Of the various situations that promote close contact, contact within the household is the only one that is easily identified, although the actual incidence among contacts and the relative risk for them appear to vary considerably in different studies. In incidence studies, infection rates for contacts of lepromatous leprosy have varied from 6.2 per 1000 per year in Cebu, Philippines to 55.8 per 1000 per year in a part of Southern India.
Two exit routes of M. leprae from the human body often described are the skin and the nasal mucosa, although their relative importance is not clear. It is true that lepromatous cases show large numbers of organisms deep down in the dermis. However, whether they reach the skin surface in sufficient numbers is doubtful. Although there are reports of acid-fast bacilli being found in the desquamating epithelium of the skin, Weddell et al. have reported that they could not find any acid-fast bacilli in the epidermis, even after examining a very large number of specimens from patients and contacts. In a recent study, Job et al. found fairly large numbers of M. leprae in the superficial keratin layer of the skin of lepromatous leprosy patients, suggesting that the organism could exit along with the sebaceous secretions.
The importance of the nasal mucosa was recognized as early as 1898 by Schäffer, particularly that of the ulcerated mucosa. The quantity of bacilli from nasal mucosal lesions in lepromatous leprosy was demonstrated by Shepard as large, with counts ranging from 10,000 to 10,000,000. Pedley reported that the majority of lepromatous patients showed leprosy bacilli in their nasal secretions as collected through blowing the nose. Davey and Rees indicated that nasal secretions from lepromatous patients could yield as much as 10 million viable organisms per day.
The entry route of M. leprae into the human body is also not definitely known. The two seriously considered are the skin and the upper respiratory tract. While older research dealt with the skin route, recent research has increasingly favored the respiratory route. Rees and McDougall succeeded in the experimental transmission of leprosy through aerosols containing M. leprae in immune-suppressed mice, suggesting a similar possibility in humans. Successful results have also been reported on experiments with nude mice when M. leprae were introduced into the nasal cavity by topical application. In summary, entry through the respiratory route appears the most probable route, although other routes, particularly broken skin, cannot be ruled out. The CDC notes the following assertion about the transmission of the disease: "Although the mode of transmission of Hansen's disease remains uncertain, most investigators think that M. leprae is usually spread from person to person in respiratory droplets."
In leprosy both the reference points for measuring the incubation period and the times of infection and onset of disease are difficult to define; the former because of the lack of adequate immunological tools and the latter because of the disease's slow onset. Even so, several investigators have attempted to measure the incubation period for leprosy. The minimum incubation period reported is as short as a few weeks and this is based on the very occasional occurrence of leprosy among young infants. The maximum incubation period reported is as long as 30 years, or over, as observed among war veterans known to have been exposed for short periods in endemic areas but otherwise living in non-endemic areas. It is generally agreed that the average incubation period is between 3 to 5 years.
Treatment
Until the development of dapsone, rifampin, and clofazimine in the 1940s, there was no effective cure for leprosy. However, dapsone is only weakly bactericidal against M. leprae and it was considered necessary for patients to take the drug indefinitely. Moreover, when dapsone was used alone, the M. leprae population quickly evolved antibiotic resistance; by the 1960s, the world's only known anti-leprosy drug became virtually useless.
The search for more effective anti-leprosy drugs than dapsone led to the use of clofazimine and rifampicin in the 1960s and 1970s. Later, Indian scientist Shantaram Yawalkar and his colleagues formulated a combined therapy using rifampicin and dapsone, intended to mitigate bacterial resistance. Multidrug therapy (MDT) and combining all three drugs was first recommended by a WHO Expert Committee in 1981. These three anti-leprosy drugs are still used in the standard MDT regimens. None of them are used alone because of the risk of developing resistance.
Because this treatment is quite expensive, it was not quickly adopted in most endemic countries. In 1985 leprosy was still considered a public health problem in 122 countries. The 44th World Health Assembly (WHA), held in Geneva in 1991 passed a resolution to eliminate leprosy as a public health problem by the year 2000 — defined as reducing the global prevalence of the disease to less than 1 case per 100,000. At the Assembly, the World Health Organization (WHO) was given the mandate to develop an elimination strategy by its member states, based on increasing the geographical coverage of MDT and patients’ accessibility to the treatment.
The WHO Study Group's report on the Chemotherapy of Leprosy in 1993 recommended two types of standard MDT regimen be adopted. The first was a 24-month treatment for multibacillary (MB or lepromatous) cases using rifampicin, clofazimine, and dapsone. The second was a six-month treatment for paucibacillary (PB or tuberculoid) cases, using rifampicin and dapsone. At the First International Conference on the Elimination of Leprosy as a Public Health Problem, held in Hanoi the next year, the global strategy was endorsed and funds provided to WHO for the procurement and supply of MDT to all endemic countries.
Between 1995 and 1999, WHO, with the aid of the Nippon Foundation (Chairman Yohei Sasakawa, World Health Organization Goodwill Ambassador for Leprosy Elimination), supplied all endemic countries with free MDT in blister packs, channelled through Ministries of Health. This free provision was extended in 2000 with a donation by the MDT manufacturer Novartis, which will run until at least the end of 2010. At the national level, non-government organisations (NGOs) affiliated to the national programme will continue to be provided with an appropriate free supply of this WHO supplied MDT by the government.
MDT remains highly effective and patients are no longer infectious after the first monthly dose. It is safe and easy to use under field conditions due to its presentation in calendar blister packs. Relapse rates remain low, and there is no known resistance to the combined drugs.[4] The Seventh WHO Expert Committee on Leprosy, reporting in 1997, concluded that the MB duration of treatment — then standing at 24 months — could safely be shortened to 12 months "without significantly compromising its efficacy."
Persistent obstacles to the elimination of the disease include improving detection, educating patients and the population about its cause, and fighting social taboos about a disease for which patients have historically been considered "unclean" or "cursed by God" as outcasts. Where taboos are strong, patients may be forced to hide their condition (and avoid seeking treatment) to avoid discrimination. The lack of awareness about Hansen's disease can lead people to falsely believe that the disease is highly contagious and incurable.
The ALERT hospital and research facility in Ethiopia provides training to medical personnel from around the world in the treatment of leprosy, as well as treating many local patients. Surgical techniques, such as for the restoration of control of movement of thumbs, have been developed there.
Prevention
A single dose of rifampicin is able to reduce the rate of leprosy in contacts by 57% to 75%. BCG is able to offer a variable amount of protection against leprosy as well as against tuberculosis.
Epidemiology
World distribution of leprosy - 2003.
Worldwide, two to three million people are estimated to be permanently disabled because of Hansen's disease. India has the greatest number of cases, with Brazil second and Myanmar third. In 1999, the world incidence of Hansen's disease was estimated to be 640,000; in 2000, 738,284 cases were identified. In 1999, 108 cases occurred in the United States. In 2000, the World Health Organization (WHO) listed 91 countries in which Hansen's disease is endemic. India, Myanmar and Nepal contained 70% of cases. In 2002, 763,917 new cases were detected worldwide, and in that year the WHO listed Brazil, Madagascar, Mozambique, Tanzania and Nepal as having 90% of Hansen's disease cases.
According to recent figures from the WHO, new cases detected worldwide have decreased by approximately 107,000 cases (or 21%) from 2003 to 2004. This decreasing trend has been consistent for the past three years. In addition, the global registered prevalence of HD was 286,063 cases; 407,791 new cases were detected during 2004.
Hansen's disease is tracked by the Centers for Disease Control and Prevention (CDC). Its prevalence in the United States is believed to be rising and underreported. Although the number of cases worldwide continues to fall, pockets of high prevalence continue in certain areas such as Brazil, South Asia (India, Nepal), some parts of Africa (Tanzania, Madagascar, Mozambique) and the western Pacific.
Risk groups
At highest risk are those living in endemic areas with poor conditions such as inadequate bedding, contaminated water and insufficient diet, or other diseases (such as HIV) that compromise immune function. Recent research suggests that there is a defect in cell-mediated immunity that causes susceptibility to the disease. Less than ten percent of the world's population is actually capable of acquiring the disease[citation needed]. The region of DNA responsible for this variability is also involved in Parkinson's disease, giving rise to current speculation that the two disorders may be linked in some way at the biochemical level. In addition, men are twice as likely to contract leprosy as women.
Disease burden
Although annual incidence — the number of new leprosy cases occurring each year — is important as a measure of transmission, it is difficult to measure in leprosy due to its long incubation period, delays in diagnosis after onset of the disease and the lack of laboratory tools to detect leprosy in its very early stages.
Instead, the registered prevalence is used. Registered prevalence is a useful proxy indicator of the disease burden as it reflects the number of active leprosy cases diagnosed with the disease and retrieving treatment with MDT at a given point in time. The prevalence rate is defined as the number of cases registered for MDT treatment among the population in which the cases have occurred, again at a given point in time.
New case detection is another indicator of the disease that is usually reported by countries on an annual basis. It includes cases diagnosed with onset of disease in the year in question (true incidence) and a large proportion of cases with onset in previous years (termed a backlog prevalence of undetected cases). The new case detection rate (NCDR) is defined by the number of newly detected cases, previously untreated, during a year divided by the population in which the cases have occurred.
Endemic countries also report the number of new cases with established disabilities at the time of detection, as an indicator of the backlog prevalence. However, determination of the time of onset of the disease is generally unreliable, is very labour-intensive and is seldom done in recording these statistics.
History

G. H. A. Hansen, discoverer of Mycobacterium leprae
Numerous leprosaria, or leper hospitals, sprang up in the Middle Ages; Matthew Paris estimated that in the early thirteenth century there were 19,000 across Europe. The first recorded leprosarium was in Harbledown. (See Leper colony.) These institutions were run along monastic lines and, while lepers were encouraged to live in these monastic-type establishments, this was for their own health as well as quarantine. Indeed, some medieval sources indicate belief that those suffering from leprosy were considered to be going through Purgatory on Earth, and for this reason their suffering was considered more holy than the ordinary person's. More frequently, lepers were seen to exist in a place between life and death: they were still alive, yet many chose or were forced to ritually separate themselves from mundane existence.
Radegund was noted for washing the feet of lepers. Orderic Vitalis writes of a monk, Ralf, who was so overcome by the plight of lepers that he prayed to catch leprosy himself (which he eventually did). The leper would carry a clapper and bell to warn of his approach, and this was as much to attract attention for charity as to warn people that a diseased person was near.
Mycobacterium leprae, the causative agent of leprosy, was discovered by Gerhard Henrik Armauer Hansen in Norway in 1873, making it the first bacterium to be identified as causing disease in humans. Historically, individuals with Hansen's disease have been known as lepers, however, this term is falling into disuse as a result of the diminishing number of leprosy patients and the pejorative connotations of the term. The term most widely accepted among people and agencies working in the field of Hansen's disease is "people affected by Hansen's disease."
Historically, the term Tzaraath from the Hebrew Bible was, erroneously, commonly translated as leprosy, although the symptoms of Tzaraath were not entirely consistent with leprosy and rather referred to a variety of disorders other than Hansen's disease.
In particular, tinea capitis (fungal scalp infection) and related infections on other body parts caused by the dermatophyte fungus Trichophyton violaceum are abundant throughout the Middle East and North Africa today and might also have been common in biblical times. Similarly, the related agent of the disfiguring skin disease favus, Trichophyton schoenleinii, appears to have been common throughout Eurasia and Africa before the advent of modern medicine. Persons with severe favus and similar fungal diseases (and potentially also with severe psoriasis and other diseases not caused by microorganisms) tended to be classed as having leprosy as late as the 17th century in Europe. This is clearly shown in the painting Governors of the Home for Lepers at Haarlem 1667 by Jan de Bray (Frans Hals Museum, Haarlem, the Netherlands), where a young Dutch man with a vivid scalp infection, almost certainly caused by a fungus, is shown being cared for by three officials of a charitable home intended for leprosy sufferers. The use of the word "leprosy" before the mid-19th century, when microscopic examination of skin for medical diagnosis was first developed, can seldom be correlated reliably with Hansen's disease as we understand it today.
The word "leprosy" derives from the ancient Greek words leprós, a scale, and lépein, to peel. The word came into the English language via Latin and Old French. The first attested English use is in the Ancrene Wisse, a 13th-century manual for nuns ("Moyseses hond..bisemde o þe spitel uuel & þuhte lepruse." The Middle English Dictionary, s.v., "leprous"). A roughly contemporaneous use is attested in the Anglo-Norman Dialogues of Saint Gregory, "Esmondez i sont li lieprous" (Anglo-Norman Dictionary, s.v., "leprus").

Mycobacterium leprae, also known as Hansen’s bacillus, mostly found in warm tropical countries, is the bacterium that causes leprosy (Hansen's disease). It is an intracellular, pleomorphic, acid fast bacterium. M. leprae is a Gram-positive, aerobic rod-shaped (bacillus) surrounded by the characteristic waxy coating unique to mycobacteria. In size and shape, it closely resembles Mycobacterium tuberculosis. Due to its thick waxy coating, M. leprae stains with a carbol fuscin rather than with the traditional Gram stain. The culture takes several weeks to mature.
Optical microscopy shows M. leprae in clumps, rounded masses, or in groups of bacilli side by side. It was discovered in 1873 by the Norwegian physician Gerhard Henrik Armauer Hansen, who was searching for the bacteria in the skin nodules of patients with leprosy. It was the first bacterium to be identified as causing disease in man.
The organism has never been successfully grown on an artificial cell culture media. Instead it has been grown in mouse foot pads and more recently in nine-banded armadillos. This can be used as a diagnostic test for the presence of bacillus in body lesions of suspected leprosy patients. The bacterium can infect armadillos, so it is studied in them. The difficulty in culturing the organism appears to be due to the fact that the organism is an obligate intracellular parasite that lacks many necessary genes for independent survival. The complex and unique cell wall that makes members of the Mycobacterium genus difficult to destroy is apparently also the reason for the extremely slow replication rate. Virulence factors include a waxy exterior coating, formed by the production of mycolic acids unique to Mycobacterium.
M. leprae was sensitive to dapsone (diaminodiphenylsulfone, the first effective treatment which was discovered for leprosy in the 1940's), but resistance against this antibiotic has developed over time. Therapy with dapsone alone is now strongly contraindicated. Currently, a multidrug treatment (MDT) is recommended by the World Health Organization, including dapsone, rifampicin and clofazimine. In patients receiving the MDT, a high proportion of the bacilli die within a short amount of time without immediate relief of symptoms. This suggests that many symptoms of leprosy must be due in part to the presence of dead cells.
Mycobacterium leprae genome
Mycobacterium leprae has the longest doubling time of all known bacteria and has thwarted every effort at culture in the laboratory. Comparing the genome sequence of Mycobacterium leprae with that of Mycobacterium tuberculosis provides clear explanations for these properties and reveal an extreme case of reductive evolution. Less than half of the genome contains functional genes. Gene deletion and decay appear to have eliminated many important metabolic activities, including siderophore production, part of the oxidative and most of the microaerophilic and anaerobic respiratory chains, and numerous catabolic systems and their regulatory circuits.
The genome sequence of a strain of M. leprae, originally isolated in Tamil Nadu and designated TN, has been completed recently. The sequence was obtained by a combined approach, employing automated DNA sequence analysis of selected cosmids and whole-genome 'shotgun' clones. After the finishing process, the genome sequence was found to contain 3,268,203 base pairs (bp), and to have an average G+C content of 57.8%, values much lower than the corresponding values for M. tuberculosis, which are 4, 441,529 bp and 65.6% G+C. There are 1500 genes which are common to both M. leprae and M. tuberculosis. The comparative analysis suggests that both mycobacteria derived from a common ancestor and, at one stage, had gene pools of similar size. Downsizing from a genome of 4.42 Mb, such as that of M. tuberculosis, to one of 3.27 Mb would account for the loss of some 1200 protein coding sequences. There is evidence that many of the genes that were present in the genome of M. leprae have truly been lost.
Information from the completed genome can be useful to develop diagnostic skin tests, understanding the mechanism of nerve damage, drug resistance and to identify novel drug targets for rational design of new therapeutic regimens and drugs to treat leprosy and its complications.

Gerhard Henrik Armauer Hansen (July 29, 1841 – February 12, 1912) was a Norwegian physician, remembered for his identification of the bacterium Mycobacterium leprae in 1873 as the causative agent of leprosy. Hansen was born in Bergen and studied medicine at the Royal Frederik's University (now the University of Oslo), gaining his degree in 1866. He served a brief internship at the National Hospital in Christiania (Oslo) and as a doctor in Lofoten. In 1868 Hansen returned to Bergen to study leprosy while working with Daniel Cornelius Danielssen, a noted expert.
Leprosy was regarded as largely hereditary or otherwise miasmic in origin. Hansen concluded on the basis of epidemiological studies that leprosy was a specific disease with a specific cause. In 1870-71 Hansen travelled to Bonn and Vienna to gain the training necessary for him to prove his hypothesis. In 1873, as he announced the discovery of Mycobacterium leprae in the tissues of all sufferers, although he did not identify them as bacteria, and received little support.
In 1879 he gave tissue samples to Albert Neisser who successfully stained the bacteria and announced his findings in 1880, claiming to have discovered the disease-causing organism. There was some conflict between Neisser and Hansen, Hansen as discoverer of the bacillus and Neisser as identifier of it as the etiological agent. Neisser put in some effort to downplay the assistance of Hansen. Hansen's claim was injured by his failure to produce a pure microbiological culture in an artificial medium or to prove that the rod-shaped organisms were infectious. Further Hansen had attempted to infect at least one female patient without consent and although no damage was caused, that case ended in court and Hansen lost his post at the hospital.
Hansen remained medical officer for leprosy in Norway and it was through his efforts that the leprosy acts of 1877 and 1885 were passed, leading to a steady decline of the disease in Norway from 1,800 known cases in 1875 to just 575 cases in 1901. His distinguished work was recognized at the International Leprosy Congress held at Bergen in 1909.
Hansen had suffered from syphilis since the 1860s but died of heart disease. In Bergen, Norway, a medical museum has been designated Hansen, which is often referred to as the Leprosy Museum. The University of Bergen has also dedicated a research facility to him - Armauer Hansen Building - located at Haukeland University Hospital in Bergen. The Leprosy Archives in Bergen has been nominated by UNESCO to the list:Memory of the World.
Gerhard Henrik Armauer Hansen

Gerhard Henrik Armauer Hansen (29 juillet 1841 - 12 février 1912) était un médecin bactériologiste et dermatologue norvégien. Il est resté célèbre pour sa découverte en 1873 du bacille de Hansen (Mycobacterium leprae), la bactérie responsable de la lèpre. Cette découverte revêt une importance historique, car il s'agit de la première démonstration d'une relation de causalité entre une bactérie et une maladie connue. Hansen a laissé son nom à la fois à la maladie (une éponymie commode permettant d'éviter de prononcer devant les malades le nom redouté d'une maladie stigmatisante et incurable à cette époque) et à la bactérie responsable.
Natif de Bergen en Norvège, il étudie la médecine à l'Université Royale Frederik (devenue l'Université d'Oslo) où il obtient son diplôme en 1866. Il est brièvement interne à l'Hôpital National de Christiania (Rikshospitalet), puis médecin aux Îles Lofoten. En 1868 il revient à Bergen pour étudier la lèpre avec Daniel Cornelius Danielssen, un dermatologue spécialiste reconnu de cette maladie, et dont il épousera plus tard la fille Stéphanie.
La lèpre était alors considérée comme une affection héréditaire ou causée par des « miasmes ». Sur la base de données épidémiologiques, Hansen fut conduit à soupçonner que la lèpre était une maladie causée par un agent spécifique. En 1870 et 1871 Hansen se rendit à Bonn et à Vienne pour acquérir la formation nécessaire à la démonstration de son hypothèse. C'est en 1873, qu'il fit connaître sa découverte de la présence de Mycobacterium leprae dans les tissus de tous les patients atteints de lèpre. Toutefois il ne parvint pas à prouver le caractère infectieux des corps étrangers observés au microscope et fut peu soutenu dans ce sens.
En 1879 il confia des échantillons de tissus prélevés chez des patients lépreux à Albert Neisser qui l'année suivante parvint à colorer la bactérie et prétendit avoir lui-même découvert l'agent causal de la lèpre. Il s'ensuivit une querelle entre les deux hommes dans laquelle Neisser tenta de minimiser le rôle joué par Hansen. Il est vrai que ce dernier n'était pas parvenu à cultiver le germe sur milieu artificiel ni à prouver que les organismes en forme de bâtonnets qu'il avait identifiés étaient réellement infectieux. C'est pour cette raison qu'il eût l'idée malencontreuse de faire une tentative d'inoculation à une patiente sans obtenir son consentement. Cette expérience fut sans conséquences pour la patiente, mais l'affaire alla devant les tribunaux et coûta à Hansen son poste de médecin à l'hôpital.
Il demeura toutefois médecin léprologue officiel pour la Norvège et grâce à ses efforts, les lois sur la lèpre de 1877 et 1885 furent promulgués. Elles permirent le déclin régulier de la maladie dans le pays: la prévalence passa en effet de 1800 cas en 1875 à 575 en 1901. Son œuvre fut saluée au Congrès International sur la Lèpre de Bergen, en 1909. Hansen souffrait de syphilis depuis les années 1860 mais mourut d'une crise cardiaque.
A Bergen le musée de la médecine portant le nom de Hansen est souvent considéré comme le musée de la lèpre (Lepramuseet). L'Université de Bergen lui a aussi dédié une unité de recherche, le bâtiment Armauer Hansen à l'Hôpital Universitaire Haukeland de Bergen. Les Archives de la Lèpre de Bergen ont été placées par l'UNESCO sur la Liste Mémoire du monde.
Cattedrale
Metropolitana di San Pietro
Bologna

Emblema del Cardinale Carlo Caffarra

In
alto si legge
Tu es pastor ovium Princeps Apostolorum
Tu sei pastore delle pecore o Principe degli Apostoli
La Chiesa di San Pietro è Cattedrale Metropolitana, in quanto sede del Vescovo Metropolita: centro liturgico e spirituale della diocesi di Bologna.
Notizie storiche sull’edificio si hanno solamente a partire dal sec. X, ma studi recenti e i resti archeologici esistenti sotto la chiesa portano a ritenere che la sua origine sia paleocristiana e la sua più antica forma fosse basilicale, a tre navate. In seguito al disastroso incendio del 1141 fu ricostruita in forme romaniche, poi del tutto rifatta, come al presente, a partire dal 1575.
Dapprima l’architetto Domenico Tibaldi eresse la cappella maggiore e la cripta (1575-1577) poi, partendo da una prima idea dell’architetto Ambrogio Magenta (1605), l’architetto Niccolò Donati eresse le navate laterali (1613-1618) e l’architetto Giovanni Battista Natali chiuse la grande volta sopra la navata maggiore (1621-1622), alta quanto quella della basilica vaticana a Roma.
Solo fra il 1743 ed il 1755, l’architetto Alfonso Torreggiani terminò la costruzione innalzando la prima cappella su ambo i lati e la facciata per volontà del papa Benedetto XIV (Prospero Lambertini, Bologna 1675 - Roma 1758), che aveva conservato il titolo di Arcivescovo di Bologna.
La chiesa è arricchita dai dipinti di Prospero Fontana (1579), Ludovico Carracci (1618), Marcantonio Franceschini (1728) e Donato Creti (1740) e da due gruppi plastici di particolare interesse: un Crocifisso fra la Madonna e San Giovanni Evangelista in legno, del sec. XII, e un Compianto sul Cristo morto, di Alfonso Lombardi (1522-1527). Elemento di grande importanza è il campanile (alto m. 70 circa), innalzato all’inizio del sec. XIII attorno a una preesistente torre cilindrica del X secolo.
www.bologna.chiesacattolica.it
La Cattedrale di San Pietro, in via Indipendenza 7, è la cattedrale metropolitana della città di Bologna. Vi ha sede la Cattedra dell'Arcivescovo di Bologna e Metropolita della Provincia Ecclesiastica Bolognese.
Una chiesa era già esistente nel 1028, fiancheggiata da un campanile paleoromanico a base circolare (di tradizione ravennate). La chiesa fu distrutta dal devastante incendio del 1141, così venne ricostruita e fu consacrata da papa Lucio III nel 1184. Nel 1396 fu costruito un alto protiro (portico) sulla facciata, per essere poi rifatto nel 1467. Dietro ordine del cardinale Gabriele Paleotti (Bologna 1522 - Roma 1596) l'edificio venne radicalmente ristrutturato all'interno nella a partire dal 1575. Tuttavia queste modificazioni furono talmente profonde da far crollare le volte nel 1599.
Dal 1582 venne elevata al rango di Metropolitana da papa Gregorio XIII, al secolo Ugo Boncompagni (Bologna 1502 - Roma 1585), imparentato con Ulisse Aldrovandi in quanto la madre di Ulisse era Veronica Marescalchi e la zia paterna di Veronica fu madre di Ugo. Quindi la madre di Ulisse era cugina di Ugo Boncompagni.
Venne infine riedificata all'inizio del XVII secolo e tra il 1743 e il 1747 ebbe una nuova facciata, sul disegno dell'architetto Alfonso Torreggiani e su volere del papa Benedetto XIV.
Attualmente l'interno risulta decisamente barocco, dando un'impressione di grandezza maestosa. Tra le opere d'arte si possono ammirare l'Annunciazione di Ludovico Carracci, affrescata nel lunettone centrale del presbiterio, una Crocifissione romanica in legno di cedro e un gruppo scultoreo in terracotta detto Cristo morto con le Marie piangenti di Alfonso Lombardi (inizi '500).

Famiglia Cristiana - n° 4 2008


Il
Giornale della Previdenza
dei Medici e degli Odontoiatri
n° 6 2008

